
La evolución del lobo tuvo lugar durante unos 800 000 años, cuando aparecen los primeros ejemplares morfológicamente similares al lobo (Canis lupus), hasta la aparición de las subespecies actuales Canis lupus dingo (dingo), Canis lupus lupus (lobo) y Canis lupus familiaris (perro). Los factores ecológicos, incluyendo el tipo de hábitat, el clima, la especialización en distintos tipos de presa y la competencia con otros depredadores ha influenciado mucho la estructura genética de población de los lobos y su plasticidad craneodental.[2][3][4][5]
El número de lobos experimentó un brusco descenso —o «cuello de botella»— hace 20 000 años, lo que indica que muchas poblaciones de lobos se habían extinguido ya durante el Último Máximo Glacial.[6] Sin embargo, a diferencia de muchas otras especies de mamíferos de gran tamaño, las poblaciones de lobos siguieron presentando una gran extensión territorial.[7] Además, el lobo representa el agriotipo del perro doméstico actual, pudiendo este proceder de una sola población de lobos ya extinta[6][8][9] o de varias, como apuntan modelos más recientes .[7]
YouTube Encyclopedic
-
1/1Views:95 780
-
Depredadores Prehistóricos (2007-2009) "Lobo Gigante" National Geographic HD
Transcription
Registro fósil
El registro fósil de vertebrados antiguos se compone de fragmentos dispersos de los que es a menudo imposible obtener material genético. Los investigadores, por tanto, recurren a los análisis morfológicos, pero es difícil estimar las variaciones entre los individuos de la misma y distintas especies y las relaciones entre especímenes en función del tiempo y de la ubicación. Existe debate sobre algunas observaciones, y las hipótesis apoyadas por algunos autores son rebatidas por otros.[10]
Hay un acuerdo general en los registros más antiguos, los cuales muestran que los feliformes y caniformes surgieron de la superfamilia Carnivoramorpha 43 millones de años antes del presente.[11] Entre los caniformes se incluye el género Leptocyon, de aspecto similar a los zorros, que existió hace 34 millones de años antes de ramificarse hace 11.9 millones de años en Vulpes (zorros) y Canis (coyotes, lobos y chacales). Eucyon, de tamaño parecido al de un chacal, existió en Norteamérica desde hace 10 millones de años, y hacia el Plioceno temprano, hace 5-6 millones de años, Eucyon davisi,[12] similar al coyote, invadió Eurasia. Los primeros caninos aparecieron en América del Norte en el Mioceno —hace 6 millones de años—, concretamente en el suroeste de los Estados Unidos y México. Un millón de años más tarde, Canis lepophagus, de mayor tamaño, apareció en la misma región.[13]: p58
Los cánidos que habían migrado desde América del Norte a Eurasia -Eucyon, Vulpes y Nyctereutes—, eran depredadores de pequeño a mediano tamaño, que vivieron durante finales del Mioceno y principios del Plioceno, pero no eran superdepredadores. La posición de los cánidos en la cadena alimenticia cambió cuando los miembros de género Canis se volvieron los depredadores dominantes en el Holártico.
C. chihilensis, con un tamaño similar al de un lobo moderno, apareció en el norte de China a mediados del Plioceno —hace 3-4 millones de años—. A continuación, la evolución del género se disparó por toda Eurasia a principios del Pleistoceno, hace 1.8 millones de años en lo que se conoce como «el evento del lobo», asociado con la formación del bioma llamado «estepa del mamut», durante el último periodo glacial. Tres especies se extendieron por Europa: C. arnensis, C. eutruscus, y C. falconeri.[13]: p148
A pesar de las lagunas en el registro fósil, se considera probable que los lobos surgieran de un grupo de cánidos de pequeño tamaño.[14]: p241 La evidencia morfológica[14]: p239 [15] y genética[16] coinciden en que los lobos evolucionaron durante el Plioceno y a principios del Pleistoceno a partir del mismo linaje que también dio lugar a los coyotes.[14]: p239 Los especímenes fosilizados indican que el ancestro común de lobos y coyotes existió hace 1.5 millones de años,[14]: p240 [15] mientras que el ancestro de los chacales y de los otros miembros existentes del género ya se había separado del tronco común anteriormente.[14]: p240 A partir de la separación de los linajes de lobos y coyotes existen diferentes opiniones entre los paleontólogos sobre las relaciones entre las varias especies que conformaron la evolución del lobo.[14]: p240 Estas especies se describen a continuación.
Canis lepophagus
Canis lepophagus vivió a principios del Plioceno en Norteamérica[13]. Kurten propuso que evolucionó a partir de especies norteamericanas más pequeñas de Canis del Mioceno[17] que posteriormente se expandieron por Eurasia; se piensa que estaba cercanamente relacionado o era equivalente a C. arnensis de Europa.[14]: p241 [18][19]
Según Johnston, C. lepophagus tenía un cráneo y esqueleto más esbeltos que los del coyote moderno.[20]: 385 Nowak descubrió que las primeras poblaciones tenían cráneos pequeños, delicados y entrechos, similares a los de coyotes pequeños y que podrían ser los ancestros de C. latrans.[14]: p241 Johnson notó que algunos especímenes encontrados en el cañón Cita en Texas, tenían cráneos más grandes y amplios,[20] lo que llevó a Nowak a sugerir que estaban transformándose en lobos.[14]: p241 [15]
Tedford discrepaba con estos autores por la ausencia de algunos rasgos en la morfología cráneo-dental de C. lepophagus compartidos por C. lupus y C. latrans, por lo que en su opinión no había una relación cercana con estas dos especies, aunque sugirió que era el ancestro tanto de lobos como de coyotes.[21]: p119
Canis priscolatrans
Canis priscolatrans habitó en Norteamérica a finales del Plioceno y principios del Pleistoceno.[15] El primer lobo como tal, apareció a finales del Blancano y principios del Irvintoniano,[14]: p240 [15][22] y era muy parecido o quizá idéntico a Canis edwardii.[14]: p241 [15]: 82 [23][24] Se parecía a C. rufus en el tamaño y proporciones del cráneo, pero con dentadura más compleja.[14]: p241 Sin embargo, los fósiles hallados de C. rufus no datan ese periodo, sino del finales del Rancholabreano.[14]: p242
Kurten no estaba seguro de si C. priscolatrans procedía de C. lepophagus y C. arnensis,[19] pero creía que era un ancestro de C. latrans. En su opinión, C. arnensis de Europa mostraba similitudes notorias a C. priscolatrans, y ambas especies podrían representar lo que fue una población holártica de coyotes.[18]: p27 Nowak se mostró en desacuerdo con esta interpretación y opinaba que C. priscolatrans estaba relacionado con el C. etruscus. europeo[15] Posteriormente, Kurten propuso que tanto C. priscolatrans y C. etruscus eran parte de un grupo que dio origen a C. lupus pero no estaba seguro de si habían evolucionado de manera separada de C. lepophagus o de un descendiente de C. lepophagus.[19]
En el suroeste de los Estados Unidos se han hallado restos del Plioceno tardío de Canis edwardii, caracterizado por un tamaño similar al de coyotes grandes, junto con C. lepophagus, lo que indica una relación de descendencia.[13]: p60 Tedford reconoció la especie C. edwardii[25] y consideró que la morfología cráneo-dental de C. priscolatrans estaba dentro del rango de C. edwardii y quizá no serían especies distintas.[21]: p131
Canis ambrusteri
Durante el Pleistoceno medio,[15] los lobos de Norteamérica evolucionaron hacia un mayor tamaño y los restos de dientes hallados indican que C. priscolatrans dio lugar al gran lobo C. ambrusteri [14]: 242 [26] Martin, sin embargo, expresó la opinión de que C. ambrusteri[27] era C. lupus.[28] Nowak no estaba de acuerdo y sostuvo que C. ambrusteri no estaba relacionado con C. lupus sino con C. priscolatrans, que posteriormente originó a C. dirus. Tedford observó que C. gezi sudamericano y C. nehringi compartían similitudes dentales y craneales, desarrolladas por el hipercarnivorismo, lo que indicaría que C. ambrusteri era el ancestro común de C. gezi, C. nehringi y C. dirus.[21]: 148
Canis dirus
Canis dirus vivió en América del Norte y del Sur desde el Pleistoceno tardío hasta el Holoceno.[29] C. dirus era la especie de mayor tamaño del género Canis.[13]: 52 Goulet sostuvo que C. dirus[30] era una variante de C. lupus,[31] al contrario que Nowak, Kurten y Berta, que pensaban que C. dirus no se derivaba de C. lupus.[15][19][32]
Los paleontólogos Wang, Tedford y Nowak sugirieron que C. dirus había evolucionado de C. ambrusteri,[13]: p52 [21]: 181 Nowak sostenía que había especímenes de Cumberland Cave, (Maryland) que indicaban que C. ambrusteri se estaba convirtiendo en C. dirus.[14]: p243 [33] Los dos taxones compartían características propias (sinapomorfía), lo que situaría el origen de C. dirus en el Irvintoniano tardío en las llanuras centrales del continente, desde las que se expandió para desplazar a su ancestro C. ambrusteri.[21]: 181
Canis mosbachensis
Canis mosbachensis vivió a mediados del Pleistoceno en Eurasia.[34] El holotipo de C. mosbachensis (Soergel, 1925) fue hallado en Jockgrim (Alemania). Según un estudio de 2010, la diversidad del género Canis disminuyó entre el Pleistoceno temprano y medio, y los únicos representantes en Eurasia eran los lobos del grupo C. mosbachensis–C. variabilis, comparables en tamaño a la especie actual Canis lupus pallipes y Canis (Xenocyon) lycaonoides, de talla similar a los lobos grises modernos.[35] C. mosbachensis apareció entre los C. etruscus del Pleistoceno temprano y los C. lupus modernos.[14]: p242 C. mosbachensis era más pequeño que los lobos de Norteamérica y C. rufus,[14]: p242 [36][14]: p242 [34] pero a lo largo del tiempo aumentó de tamaño.
Nowak propuso que C. mosbachensis era el ancestro de los lobos de Eurasia y América del Norte y que una población de C. mosbachensis invadió América del Norte donde quedó aislado por la glaciación y dio lugar a C. rufus. Otra población de C. mosbachensis permaneció en Eurasia donde se convirtió en C. lupus, que finalmente invadió Norteamérica.[14]: p242 Tedford comparó C. mosbachensis —que llegó a ocupar desde Europa del Este hasta Kazajistán— y C. variabilis —que habitaba desde Kazajistán a China—. La única diferencia entre ellos era la posición de los huesos nasales, que en C. variabilis «acababan en o antes de la posición más posterior de la sutura frontal-maxilar», por lo que ambos taxones podrían representar distintas variaciones de un único lobo del Pleistoceno medio con una amplia distribución geográfica.[21]: p181
Existe amplio acuerdo en que el lobo moderno, C. lupus desciende de C. etruscus vía C. mosbachensis.[10][34][35][37][38][39][40][41][42][43][44][45][46] Lumley consideraba a C. mosbachensis como subespecie del lobo gris, por lo que propuso el nombre de C. lupus mosbachensis.[47] Sin embargo, otros investigadores no aceptan la relación anatómica entre C. mosbachensis y C. etruscus y opinan que se parece más a C. arnensis, [48][49][50] con un tamaño y una dentadura más similares a los de un chacal omnívoro.[50]
Canis chihliensis
Wang y Tedford defendían que el género Canis descendía de Eucyon davisi, y que sus primeros restos aparecieron en el Mioceno (hace 6 millones de años) en el suroeste de Estados Unidos y México. Hacia el Plioceno (5 millones de años), Canis lepophagus de mayor tamaño, apareció en la misma región y en el Pleistoceno temprano (hace 1 millón de años) Canis latrans (el coyote) ya existía. Propusieron que la progresión de Eucyon davisi a C lepophagus al coyote fue por evolución linear.[13]: p58 C. edwardii, C. latrans y C. aureus forman un pequeño clado y como C. edwardii fue el primero en aparecer, entre el Plioceno tardío y el Pleistoceno tardío, lo proponen como el ancestro.[21]: p175, 180
Nowak y Tedford también pensaban que C. lupus podría haber surgido del linaje de los cánidos del Mioceno o Plioceno que precedieron a C. lepophagus sin relación con este.[15][22] Wang y Tedford dataron los restos más antiguos de C. lupus en 800 000 años, (mediados del Pleistoceno)[21]: 5 y que los ejemplares similares a los lobos modernos[21]: p150 formaban parte de la fauna Olioriana (a inicios del Pleistoceno medio en Siberia) y la fauna del sumidero Cripple Creek en Alaska, lo que apunta al origen de estos lobos en Beringia.[21]: p181
El análisis morfológico de restos de China indica que la especie C. chihliensis del Plioceno, pudo haber sido el ancestro tanto deC. armbrusteri y de C. lupus antes de su migración a América del Norte.[13]: p148 [21]: p181 Al parecer C. chihliensis era más primitivo y pequeño que C. lupus; las medidas de su cráneo y dientes eran similares, pero los elementos postcraneales eran más pequeños.[51]
C. ambrusteri apareció en América del Norte a mediados del Pleistoceno y es el Canis de mayor tamaño de esta época.[15] A finales del retroceso glaciar más reciente, hace 30 000 años, las barreras glaciales del norte de Canadá desaparecieron, permitiendo a los mamíferos árticos como el caribú, el bisonte y el lobo gris expandirse a las latitudes medias del continente.[13]: p61 A mediados del Pleistoceno en Eurasia, C. falconeri dio paso al género hipercarnívoro Xenocyon, que después evolucionó en los géneros Cuon (dole) y Lycaon (perro cazador africano).[13]: p105, 149 Justo antes de la aparición de C. dirus, Norteamérica fue invadida por el género Xenocyon tan grande como C. dirus y más hipercarnívoro.[13]: p60 El lobo C. antonii, hallado en China entre el Plioceno tardío y el Pleistoceno temprano era una variación de C. chihliensis,[21]: p197 , mientras que C. falconeri, surgido abruptamente en Europa en el Pleistoceno temprano, tal vez representaba una extensión hacia el oeste de C. antonii.[21]: p181
Canis variabilis
En 2012, un estudio dirigido por Xiaoming Wang sobre las antiguas especies Canis en China concluyó que estas eran semejantes a C. lupus en dimensiones postcraneales y dentales, excepto por C. variabilis, descrito como «extraño» por sus dimensiones craneodentales menores que las de otras especies anteriores y posteriores.[51] El estudio sugiere que «es bastante probable que estas especies sean el ancestro del perro doméstico Canis familiaris», una hipótesis que ya había sido propuesta anteriormente por otros autores.[52][53][54][55][56]
Canis lupus familiaris (perro doméstico)
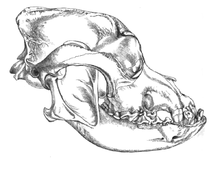

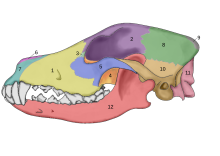
En 2002, se realizó un estudio de los fósiles craneales de dos cánidos que se encontraron enterrados a metros de la entrada de lo que fue una cabaña de huesos de mamuts en el sitio Paleolítico Superior Eliseevich-I, en la región de Briansk en la llanura Rusa; usando una definición aceptada de la domesticación basada en rasgos morfológicos, el estudi concluyó que los ejemplares eran «perros de la Era del Hielo». La datación por radiocarbono dio una antigüedad estimada de 16 945-13 905 años.[57] En 2013, un segundo estudio analizó la secuencia de ADN mitocondrial de uno de los cráneos, correspondiente a Canis lupus familiaris.[58]
En 2015, un zooarqueólogo declaró que "En términos de fenotipos, perros y lobos son fundamentalmente animales diferentes."[59]
En 1986, un estudio de la morfología del cráneo concluyó que el perro doméstico es morfológicamente muy diferente de todos los demás cánidos, con la excepción de los lobos y especies cercanas. Aunque las diferencias en tamaño y proporción entre algunas razas de perros son comparables a las existentes entre otros géneros no domesticados, es evidente que todos los perros son miembros de la misma especie.[60] Un estudio de 2010 también había hallado que las diferencias en la forma del cráneo de los perros claramente superan la máxima divergencia entre otras especies de carnívoros y que algunas de las formas presentes en los perros domésticos no se encontraban en ningún carnívoro salvaje.[61]
El cráneo del perro doméstico varía entre 7 y 28 cm de longitud (McGreevy, 2004). En comparación, los lobos son dolicocéfalos (de cráneo largo) pero no tanto como algunas razas como los galgos y los loberos rusos (McGreevy 2004). Entre los caninos, la braquiocefalia se da solamente en los perros domésticos y se relaciona con el pedomorfismo (Goodwin 1997): los perros conservan a menudo el hocico y cráneo cortos característicos de los cachorros (Coppinger 1995). Existen otras diferencias entre los perros braquiocefálicos y dolicocéfalos, como el ángulo craneofacial —ángulo entre el eje basilar y el paladar duro— (Regodón 1993), la morfología de la articulación temporomandibular (Dickie 2001), y la anatomía radiográfica de la lámina cribosa (Schwarz 2000).[62]
Muchos autores han llegado a la conclusión de que en comparación con el lobo adulto existente, el perro doméstico adulto tiene un rostro (parte frontal del cráneo) relativamente reducido, un hueso frontal elevado, un paladar más amplio, un cráneo amplio, y dientes más pequeños (Hildebrand1954; Clutton- Brock, Corbet y Hills, 1976; Olsen 1985; Wayne 1986; Hemmer 1990; Morey 1990). Otros autores no concuerdan y opinan que las estos rasgos están sujetos a variaciones en las dos especies y los rangos coinciden (Crockford 1999; Harrison 1973). Los cachorros de los lobos tienen proporciones craneales similares a los perros adultos, lo que se propone como prueba de que el perro doméstico es un lobo neoténico. Esto se explica por la selección humana de ejemplares de aspecto juvenil o por pleiotropía, como resultado de la selección por un comportamiento juvenil (Clutton-Brock 1977; Belyaev 1979; Wayne 1986; Coppinger y Schneider 1995). Wayne (1986) llegó a la conclusión de que los perros no tenían un acortamiento significativamente relativo del rostro en comparación con los lobos, poniendo en duda esta característica de identificación.[52]
En comparación con el lobo, la dentición del perro es relativamente menos robusta (Olsen 1985; Hemmer 1990), lo que se explica como una relajación de la selección natural cuando los lobos cambiaron de dieta tras su domesticación, o por selección artificial (Olsen 1985; Clutton-Brock 1995). Kieser y Groeneveld (1992) compararon las medidas mandibulodentales de chacales como C. adustus y C. mesomelas y zorros Cabo (Vulpes chama) con las de perros de equivalente de tamaño y concluyeron que, aunque los caninos de estos otros cánidos tendían a ser ligeramente más pequeños y sus segundos molares más grandes, las proporciones eran esencialmente las mismas en todas las especies. Esto pone en duda la suposición de que los dientes de perros sean relativamente pequeños debido a la selección reciente y sugiere que la dentición del perro es una plesiomorfia proveniente de un antepasado de tamaño más reducido que el lobo.[52]
La reducción del tamaño corporal de los primeros perros en comparación con un lobo se cree debido a la selección de nicho (Olsen 1985; Morey 1992; Coppinger y Coppinger 2001). Morey (1992: 199) afirma que "Los resultados... son coherentes con la hipótesis de que los primeros perros domésticos son pedomorfos evolutivos, productos de fuerte selección para la reducción del tamaño de ontogenéticamente canalizado y alteraciones del calendario reproductivo asociado a la nueva forma doméstica de la vida."[52] Sin embargo, en un experimento domesticación, los zorros domesticados se mantuvieron el mismo tamaño que los zorros no seleccionados (Trutt 1999: 167).[59]
Wayne (1986) concluyó que la morfología craneal del perro es más similar a la de C. latrans, C. aureus, C. adustus, C. mesomelas, Cuon alpinus y Lycaon pictus que a la del lobo. Dahr (1942) llegó a la conclusión de que el neurocráneo del perro es más parecido al de los coyotes que al de los lobos. Manwell y Baker (1983) revisaron el trabajo de Dahr con la adición de los datos dentales para los cánidos y llegaron a la conclusión de que el ancestro del perro se encontraba probablemente en el rango de 13,6-20;5 kg, menor que el rango de 27-54 kg para los lobos existentes (Mech 1970 ) y comparable al del dingo.[52]
El hueso timpánico del perro es más pequeño y plano que el del lobo (Harrison 1973; Clutton-Brock, Corbet & Hill 1976; Nowak 1979; Olsen 1985; Wayne 1986), quizá porque en estado doméstico el perro ya no requiere la audición aguda del lobo. Sin embargo, se ha demostrado que la forma de este hueso incrementa la sensibilidad a ciertas frecuencias específicas, pero la forma y el tamaño no se puede correlacionar con la agudeza auditiva (Ewer 1973). Por lo tanto, puede ser el caso que el hueso timpánico del perro haya conservado su forma ancestral.[52]
En los perros, el margen ventral de la rama horizontal de la mandíbula forma una curva convexa que no aparece en los lobos (Olsen 1985; Clutton-Brock, 1995), pero no hay comentarios sobre esta diferencia en la literatura. Sin embargo, Biknevicius y Van Valkenburgh (1997) se percataron que en los carnívoros que consumen huesos la rama horizontal presenta un abultamiento en el margen dorsoventral. Este mayor grosor puede haber sido una adaptación de los antepasados del perro a un nicho de alimentación diferente al de los lobos.[52] Un estudio de la morfología de la superficie del cerebro en los chacales C. mesomelas y C. aureus, el coyote C. latrans, los lobos C. lupus y C. rufus y el perro, indicó que el cerebelo de este último se aproxima mucho al del coyote, parecido al de los chacales, y que los lobos muestran numerosos rasgos diferentes a los de otras especies (Atkins y Dillon 1971). Los lobos también tienen características serológicas y bioquímicas distintas a las de los perros (Leona y Wiens 1956; Lauer, Kuyt & Baker 1969).[52]
Durante el Último Máximo Glacial, la diversidad genética del lobo era mayor que en la actualidad,[6][58] y la variedad de ecosistemas habría dado lugar a distintos ecotipos con diferencias genéticas y morfológicos entre sí.[63] Las diferencias entre los lobos y perros modernos podrían provenir de las adaptaciones de sus respectivos antepasados a distintos nichos.[52]
Estudios genéticos
Secuencia de ADN
Las mitocondrias contienen su propio genoma, compuesto de ADN circular, que en los mamíferos es de una longitud de 16 000-18 000 pares de bases. Una célula contiene cientos o miles de mitocondrias y por lo tanto los genes mitocondriales son más abundantes que los genes del genoma nuclear.[64][65] La abundancia de ADN mitocondrial (ADNmt) es útil para el análisis genético de restos antiguos en el que el ADN se ha degradado.[65][66]
Las secuencias de ADN mitocondrial tienen una tasa de mutación más alta que la de los genes nucleares; en el caso de los mamíferos la tasa de mutación es 5-10 veces mayor.[65][67][68] Esta rápida evolución del ADNmt supone una herramienta muy útil para inferir la historia de la evolución al nivel de familias, géneros y especies, pero introduce un elemento de incertidumbre en el reloj molecular. Para determinar la situación taxonómica de especies inciertas se prefiere el uso del ADN nuclear, que es más adecuado para el análisis de la historia reciente.[69] El ADNmt se hereda del ancestro materno,[65][70] por lo que su análisis filogenético proporciona una historia de los linajes maternales que se pueden representar como un árbol filogenético.[65][71][72]
| De espécimen a árbol filogenético | ||||||||||||
| ||||||||||||
Las mutaciones que son diferentes en estas secuencias del genoma de cuatro cánidos se han numerado y resaltado. Estas mutaciones se pueden utilizar para construir un árbol filogenético para las cuatro especies. En este ejemplo, el perro y el lobo gris se diferencian por dos sustituciones (resaltadas en rojo), y cada uno de ellos difiere del coyote por cuatro sustituciones.[65]
1 2 3 4 5 67
Chacal dorado A-G-C-T-G-T-C-GA-T-TC-CA
Coyote A-G-C-T-A-T-C-GA-A-TC-GA
Lobo T-G-C-T-A-T-G-GA-T-TC-CT
Perro T-G-G-T-A-T-G-GA-T-TC-CA
Las secuencias de ADN mitocondrial del perro y el lobo se diferencian en 0-12 sustituciones en 261 pares de bases, mientras que los perros difieren de los coyotes y chacales por lo menos en 20 sustituciones.[65][74] Este hallazgo implica bien que el perro deriva del lobo y que ha habido mucho retrocruzamiento,[74] o bien que el perro desciende de una especie ya extinta cuyo pariente vivo más cercano es el lobo moderno.[75]
Problemas con los marcadores genéticos
Los resultados de los estudios de ADN dependen de los especímenes seleccionados, la tecnología utilizada, y las suposiciones a priori, y a veces los resultados no son concluyentes.[76] Hay varios marcadores genéticos que se pueden seleccionar para un estudio dado, y los árboles filogenéticos pueden arrojar resultados inconsistentes sobre la relación entre el lobo, el perro y el coyote. Dos análisis basados en polimorfismos de nucleótido único[77] y en secuencias genéticas nucleares respectivamente dieron como resultado que los perros estaban más próximos a los coyotes que a los lobos, mientras que otro estudio situó a los lobos junto a los coyotes y ambos separados de los perros.[78] Otras investigaciones basadas en otros marcadores confirman la teoría más ampliamente aceptada de que los lobos y los perros forman un grupo separado de los coyotes.[74][79] Estos resultados dispares demuestran que hay que interpretar los resultados de estudios genéticos con precaución.[77]
Problemas de sincronización
Existen dos hipótesis necesarias para determinar el tiempo de divergencia entre especies: el tiempo entre generaciones y la tasa de mutación genética por generación. Se supone que el tiempo entre generaciones es de tres años para los lobos y de dos años para los perros, basándose en las especies actuales.[80] Un estudio importante reciente presumió dos años entre generaciones de perros en los últimos 10 000 años y tres años anteriormente para calcular cuándo se produjo la divergencia entre lobos y perros.[6]
La tasa de mutación es la principal fuente de incertidumbre en los estudios genéticos.[6] En 2005, Lindblad-Toh secuenció por primera vez un genoma del perro, y calculó una tasa de mutación de 1x10-8 mutaciones por generación.[80] En 2015, Skoglund logró secuenciar el genoma de un lobo del Pleistoceno —«lobo de Taimyr»— y usó la datación por radiocarbono para validar la tasa de mutación genética de 0.4x10-8 mutaciones por generación.[8] La diferencia supone un factor de 2,5. Dado que solo un ejemplar de lobo antiguo había sido secuenciado, este resultado fue tratado con precaución,[9] aunque un segundo análisis del ejemplar de 4800 años conocido como «perro de Newgrange», concordó con la tasa de mutación del lobo de Taimyr.[81]
Cánidos similares a lobos
Los cánidos similares a lobos son un grupo de grandes carnívoros genéticamente relacionados con 78 cromosomas. El grupo incluye los géneros Canis, Cuon y Lycaon. Sus miembros son el perro (C. lupus familiaris), el lobo gris (Canis lupus), el coyote (Canis latrans), el chacal dorado (Canis aureus), el lobo etíope (Canis simensis), chacal de espalda negra (Canis mesomelas), el chacal del lado rayado(Canis adustus), el dole (Cuon alpinus), y el perro salvaje africano (Lycaon pictus).[82] Se han propuesto nuevos miembro, entre los que se incluyen el lobo rojo (Canis rufus), el lobo del este (Canis lycaon), y el lobo dorado africano (Canis anthus). Al tener el mismo número de cromosomas, todas estas especies son indistinguibles desde el punto de vista cariotípico.[65]: p279 [83] Los miembros del género Canis pueden potencialmente cruzarse[75], y hay pruebas de que el lobo etíope se ha hibridado con los perros.[84] Según el zoólogo Reginald Pocock, un dole se cruzó con un chacal dorado.[85] El perro salvaje africano es grande, ágil, capaz de cubrir grandes distancias y se encuentra raramente en gran parte de su área de distribución geográfica,[86] lo que dificulta la hibridación. Un estudio del ADN mitocondrial de los chacales de lomo negro no halló ninguna huella de los genotipos del chacal rayado ni del chacal dorado, lo que indica que no ha habido cruzamientos entre estas especies y machos de chacal de lomo negro.[87] Tampoco se han encontrado indicios de hibridación del raro chacal rayado lateral.
El alineamiento de secuencias de ADN de los cánidos similares a los lobos dio como resultado un árbol filogenético en el que el lobo gris y el perro tienen el parentesco más cercano. Les siguen por afinidad el coyote, el chacal dorado y el lobo etíope, especies con las que el perro puede hibridarse en la naturaleza. A continuación se encuentran el dole y el perro salvaje africano, que se distinguen por los colmillos, únicos entre los cánidos.[80] Las dos especies de chacales africanos son los miembros más basales de este clado, lo que sugiere un origen africano para el grupo.[80][88] El árbol ilustra la distinción genotipo-fenotipo, donde el genotipo comprende información hereditaria de un organismo y el fenotipo es el conjunto de características presentes en el organismo, como la morfología, el desarrollo o el comportamiento. Por fenotipo, el dole (género Cuon) y el perro salvaje africano (género Lycaon) no se clasifican como miembros del género Canis, pero por el genotipo están más cerca de los perros, lobos y coyotes que el chacal rayado (Canis adustus) y el chacal de lomo negro (Canis mesomelas). En 2014, un estudio del genoma entero indicó que los ancestros del chacal dorado y del lobo y coyote habían divergido hace 400 000 años, mucho más recientemente que las estimaciones previas de 1,9 millones de años basadas en el ADN mitocondrial y una tasa de mutación peor determinada.[6] Usando una tasa de mutación por generación diferente (Skoglund 2015),[8] se calculó el tiempo de divergencia en algo menos de un millón de años.
Dos haplogrupos de lobos
Un haplotipo (genotipo haploide) es un grupo de genes en un organismo que se heredan juntos de un solo padre.[89][90] Un haplogrupo es un grupo de haplotipos similares que comparten un ancestro común con una mutación de polimorfismo de nucleótido único.[91][92] En 2010, un estudio comparó un par de secuencias de 230 pares de bases de ADN mitocondrial de 24 ejemplares de lobos de Europa occidental, con una antigüedad de entre 44 000 y 1200 años, con las secuencias equivalentes de los lobos grises modernos. La mayor parte de las secuencias pudieron representarse en un árbol filogenético. Sin embargo, los haplotipos del lobo del Himalaya y el lobo gris indio tenían ocho mutaciones no presentes en los otros lobos,[93] indicando la existencia de distintos linajes, como ya se había determinado en otros estudios.[93][94][95] El estudio distinguió 75 diferentes haplotipos de mRNA del lobo gris, de los cuales 23 se encuentran en Europa, 30 en Asia, 18 en América del Norte, 3 en Europa y Asia y 1 en Europa y América del Norte.[93] Estos haplotipos conforman dos haplogrupos separados por 5 mutaciones. El haplogrupo 1 forma un clado monofilético, es decir, todos los haplotipos tienen la misma mutación heredada de un único ancestro femenino. Todos los otros haplotipos son basales, y forman dos o tres clados menores asignados al haplogrupo 2 (no monofilético).[93][96] Los haplogrupos 1 y 2 están repartidos por toda Eurasia, pero solo el haplogrupo 1 se encontró en América del Norte. Todas las muestras antiguas de Europa occidental pertenecían al haplogrupo 2, lo que indica que el haplogrupo 2 predominó en esta región durante más de 40 000 años antes y después del Último Máximo Glacial. La comparación de las frecuencias actuales y pasadas muestra que en Europa el haplogrupo 2 fue superado en número por el haplogrupo 1 durante los últimos miles de años, mientras que en América del Norte el haplogrupo 2 se extinguió totalmente y fue reemplazado por el haplogrupo 1 después de la última glaciación.[93][96] El continente americano era accesible por tierra entre hace 20 000 y 11 000 años, después de que finalizara la glaciación de Wisconsin, pero antes de que el puente de tierra de Bering se inundara.[97] Por lo tanto, el haplogrupo pudo llegar a América del Norte durante este período.
El análisis isotópico de los huesos de ejemplares antiguos arrojó información sobre la dieta y, por consiguiente, la ecología de las poblaciones de lobos extintos. Los lobos del Pleistoceno del haplogrupo 2 de Beringia y Bélgica depredaban principalmente la megafauna de su era,[93][98][99] que comenzó a escasear al principio del Holoceno hace 12 000 años.[93][100] Los lobos pleistocénicos euroasiáticos y del este de Beringia son morfológica y genéticamente comparables,[101] y algunos comparten el haplotipo a17,[93][98] por lo que probablemente eran también similares desde el punto de vista ecológico.[93] Los restos de dos lobos antiguos de Ucrania —«perros de Altai»— de entre 30 000 y 33 000 años de antigüedad, presentan la misma secuencia que seis lobos de Beringia, y otro ejemplar de la República Checa de 44 000 años tenía la misma secuencia que dos lobos de Beringia.[98] Con estos datos, se ha propuesto que los lobos del Pleistoceno de todo el norte de Eurasia y de Norteamérica representaban una población continua y casi panmíctica que era genéticamente y probablemente también ecológicamente distinta de los lobos que viven en esta área en la actualidad.[93][102] Los lobos del Pleistoceno no contribuyeron a la diversidad genética de los lobos modernos, y es probable que las poblaciones actuales de lobos del Holártico sean los descendientes de lobos provenientes de refugios más meridionales.[102] El actual haplogrupo 2 existe en Italia, los Balcanes y los Cárpatos, pero es raro en otras partes de Europa. En Asia, solo cuatro haplotipos se han identificado como pertenecientes a este haplogrupo, y dos de ellos habitan en el Oriente Próximo.[103] El haplogrupo 2 no se extinguió en Europa, y lo que conllevaría que sus antepasados fueron capaces de adaptarse a los cambios de las presas.[93] En 2013, una secuenciación del ADN mitocondrial de los antiguos cánidos similares a lobos, reveló otro linaje separado de 3 haplotipos (que forman un haplogrupo) encontrados en tres especímenes del Pleistoceno tardío en Bélgica —uno de ellos fue el denominado «perro Goyet»—[58]; sin embargo, estos haplotipos no se han hallado en los lobos modernos.[58][103]
Punto de vista alternativo

En 2016 se llevó a cabo un nuevo estudio, motivado por las críticas de que los análisis anteriores no contaban con la suficiente resolución o cobertura geográfica y no incluían suficientes muestras provenientes de Rusia, China y el Medio Oriente. En el nuevo estudio se compararon secuencias de 582 pares de bases, resultante en una resolución filogenética dos veces mejor que la del estudio previo de 2010.[93] Se incluyeron lobos modernos y antiguos, incluidos ejemplares de áreas remotas de Norteamérica, Rusia y China. Entre las muestras usadas se encontraban los lobos de Taimyr, el perro de Goyet, el perro de Alta, los lobos de Beringia y otros especímenes antiguos.[104]
Se hallaron 114 haplotipos diferentes en 314 secuencias. Los nuevos haplotipos provenían de Siberia y China. El árbol filogenético resultante consta de 19 clados; entre los clados basales están el lobo indio y el lobo del Himalaya, en cuyo clado aparece un subgrupo de lobos de China y Mongolia. Los haplotipos norteamericanos más basales incluyen el lobo mexicano y el lobo de Vancouver, aunque este comparte haplotipo con un perro, lo que indica una mezcla,[104] siendo este linaje basal a todas las subespecies de Norteamérica.[9] En Europa, los haplotipos más distintivos son los de lobo ibérico y el lobo italiano, que aparece cerca de los lobos antiguos. El lobo de Groenlandia pertenece a un haplotipo encontrado entre los lobos de Norteamérica, lo que sitúa su origen en este continente. Se confirmó que el lobo oriental era un híbrido entre el lobo y el coyote. Los lobos provenientes de la península de Chukchi, la frontera norcoreana, el óblast de Amur y Jakasia muestran la mayor diversidad genética y la mayor cercanía a todos los lobos holárticos. Un haplotipo hallado en muestras de Alaska y del norte de los Urales, de 28 000 y 18 años de antigüedad respectivamente, apareció también en lobos de China y Mongolia.[104]
En América y Japón

En 2016, en una continuación del estudio publicado en 2013 sobre el origen del perro doméstico,[58] se analizaron las secuencias de doce genes en la cadena pesada del genoma mitocondrial de subespecies extintas y modernas de C. lupus. El estudio excluyó las secuencias del lobo del Himalaya y el lobo gris indio. Los especímenes antiguos fueron datados por radiocarbono y por estratigrafía, obteniéndose así un árbol filogenético basado en el tiempo. De los datos se puede inferir que el ancestro común más reciente de todos los C. lupus —modernos y extintos— vivió hace 80 000, la misma fecha calculada en el estudio anterior.[58][105] No se pudo demostrar la existencia de un «cuello de botella» en la población de los lobos hasta hace unos pocos miles de años.[105]
El árbol filogenético resultante muestra la polifilia de los lobos americanos, con el lobo mexicano separado genéticamente de los demás lobos del continente, que forman a su vez dos clados estrechamente relacionados. Una explicación consistente con los datos filogenéticos y geográficos es que hubo una sola ola de colonización de Norteamérica por parte del lobo, cuando los niveles del mar estaban en su punto más bajo, desde la apertura del estrecho de Bering hace 70 000 años y el cierre del corredor de Yukón en la división entre la capa de hielo Laurentino y el casquete glaciar de la Cordillera hace 23 000 años. Los lobos mexicanos fueron parte de esta ola y se separaron de los otros lobos bien antes de entrar en América del Norte o bien una vez allí debido al cambio en su entorno. Los haplotipos de los lobos que ya se encontraban en el continente fueron reemplazados por los de los invasores, ya sea mediante desplazamiento competitivo o mediante mezcla.[105] La sustitución en América del Norte de una población basal de lobos por una más reciente apoya las conclusiones de estudios anteriores.[93][96][98][105] Es posible que hasta el cierre de las placas de hielo existiera una población de lobos panmíctica que abarcara Eurasia y América del Norte;[93][102][105] Una vez que las placas de hielo se cerraron, los lobos del sur quedaron aislados. Cuando se inundó el puente de Bering hace 10 000 años y los casquetes de hielo retrocedieron, los lobos de Bering se extinguieron y los lobos sureños se extendieron por todo el continente norteamericano. Los lobos actuales descienden de estos, aunque gran parte de su diversidad genética se perdió durante el siglo XX.[105]
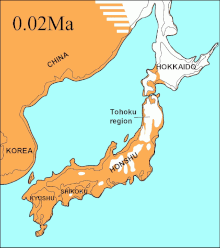
Los análisis de ADN mitocondrial indican que los lobos de la costa sureste de Alaska son genéticamente distintos de los lobos grises del interior, un patrón observado también en otros taxones. Muestran una relación filogenética con los lobos de Oklahoma, lo que indica que estos lobos son los últimos restos de un grupo que se ha reducido en gran parte durante el siglo pasado, y que los lobos del norte tienen su origen en los refugios glaciales del sur.[106][107][108] Un estudio de ADN de todo el genoma indicó que todos los lobos norteamericanos son monofiléticos y, por lo tanto, descendientes de un ancestro común.[109]
Durante el mismo período, el estrecho de Soya entre Hokkaido y la isla de Sakhalin estuvo por encima del agua durante 75 000 años, y se sugirió que el extinto lobo de Ezo (Canis lupus hattai) llegó a Hokkaido desde Sajalín.[110][105][111] Sin embargo, las secuencias genómicas apuntan a una llegada a Hokkaido más tardía, hace menos de 10 000 años. El lobo de Ezo estaba estrechamente relacionado con uno de los clados de América del Norte,[110][105][112] pero era diferente al lobo japonés (Canis lupus hodophilax), que se encontraba más al sur y es basal para los lobos modernos.[110][105] El lobo japonés habitaba Kyushu, Shikoku y las islas Honshu,[113][114] pero no la isla de Hokkaido.[114] Esto indica que su antepasado pudo haber penetrado en Japón desde el continente asiático a través de la península de Corea.[110][114] Los niveles del mar del estrecho de Corea los análisis de las secuencias de ADN de los lobos japoneses, fechan la llegada a las islas del sur de Japón en unos 20 000 años.[105]
Divergencia con los coyotes
En 2016, basándose en los resultados un estudio genético, se sugirió que todos los lobos norteamericanos y los coyotes divergieron de un ancestro común hace más de 6000-117 000 años. El mismo estudio también señaló que todos los lobos norteamericanos tienen una cantidad significativa de ascendencia de coyotes y todos los coyotes algún grado de ascendencia de lobos, y que el lobo rojo y el lobo oriental se han cruzado en diferentes proporciones con el lobo gris y el coyote. Uno de los análisis arrojó 51 000 años como la fecha en que se produjo la divergencia entre lobos y coyotes, fecha que coincide con la aparición del lobo moderno según otros estudios. Otro análisis diferente situó el momento en que los coyotes se separaron del lobo rojo en 55 000-117 000 años y del lobo de los Grandes Lagos en 32 000 años.[109][115] Los hallazgos del estudio no concuerdan con el registro fósil, donde los ejemplares similares al coyote datan de hace un millón de años.[13]
Cabe destacar que un estudio de genómica comparada realizado en el año 2022 evidenció la presencia de un 10-20% de ascendencia de coyote en los lobos norteamericanos actuales, mientras que no presentan conexión alguna con los antiguos lobos presentes en norteramérica.[7]
Perro doméstico
El perro doméstico (Canis lupus familiaris) es el carnívoro grande más abundante.[58][9][116] Durante el último millón de años, existieron muchos tipos de lobos, pero la tasa de extinción ha sido alta, y los lobos modernos no son los antepasados directos de los perros.[58][9][6][117] Aunque algunos investigadores han concluido que los perros y los lobos son parientes muy cercanos,[74][75][82] los análisis filogenéticos posteriores apoyan firmemente la hipótesis de que los perros y los lobos son taxones recíprocamente monofiléticos que forman dos clados hermanos,[74][6][118] y que ninguna población de lobos modernos está emparentada con los lobos que fueron domesticados por primera vez.[6][118] Los resultados del análisis de ADN mitocondrial de especímenes de lobos grises antiguos y modernos son compatible con una reducción y sustitución de las poblaciones antiguas.[58][93][98] Una segunda hipótesis es que durante los cambios ecológicos drásticos de finales del Pleistoceno, todos los supervivientes de un pequeño contingente de lobos se unieron a los humanos.[119][59]
En 2016, un estudio investigó por primera vez las subdivisiones de la población, la demografía y las relaciones de lobos grises en función de las secuencias de todo el genoma. El estudio indicó que el perro era una subespecie divergente del lobo gris y se derivó de una población de lobos ya extinta en el Pleistoceno tardío,[58][9][6] y que el perro y el dingo no son especies diferentes.[9] El árbol filogenético de todo el genoma indica una divergencia genética entre los lobos del Nuevo Mundo y del Viejo Mundo, seguida por otra divergencia entre los perro y los lobos del Viejo Mundo hace 27 000[8][9] o 29 000 años.[9] El perro pertenece a un taxón hermano del de los lobos grises de Eurasia, pero no de los lobos de América del Norte. Desde la divergencia de los lobos del Viejo Mundo y los perros, pasaron muchas generaciones antes de que estos últimos se separaran en distintos linajes casi tan distintos entre ellos como de los lobos.[9] El estudio sugiere que las dataciones anteriores, basadas en la fecha de la divergencia entre los lobos y coyotes estimada a partir de fósiles —un millón de años—, pueden no reflejar correctamente la ascendencia de las formas modernas.[120][8][9][6]
El mismo estudio indicó que el lobo mexicano era también una especie derivada del lobo gris y sus antepasados pudieron ser parte de una invasión temprana a Norteamérica.[9][117] Entre los lobos del Eurasia, el lobo tibetano presentó el mayor grado de divergencia de todos los ejemplares, habiendo sufrido un cuello de botella poblacional, y solo recientemente había vuelto a colonizar la meseta del Tíbet. La glaciación pudo haber causado una pérdida de hábitat y un aislamiento genético, que a su vez le llevó a una adaptación a las condiciones locales.[9] Otra conclusión derivada del estudio fue que ha habido una gran mezcla genética entre los perros domésticos y los lobos, y hasta un 25 % del genoma de los lobos del Viejo Mundo muestra signos de ascendencia perruna, posiblemente como resultado del flujo de genes de perros a los lobos ancestrales. Hay indicios de la presencia de genes de los lobos europeos y el lobo israelí en las razas de perro basenji y bóxer.[9][6] Por su parte, los lobos de Rusia central y del este y los lobos chinos de las tierras bajas comparten bastantes genes con los perros indígenas chinos, el mastín tibetano y el dingo. Por el contrario, los lobos tibetanos no mostraron indicios de mezcla significativa con los perros; sin embargo, los lobos Qinghai parecen haber intercambiado genes con los dingos y, en el caso de un ejemplar, con los perros chinos. Los lobos americanos no tienen relación con el bóxer, el dingo o los perros indígenas chinos pero se hallaron indicios de flujo genético entre el lobo mexicano y el basenji africano.[9] Todas las especies del género Canis poseen 78 cromosomas y, potencialmente, pueden cruzarse.[75] Hay evidencia de presencia de genes del chacal dorado a la población ancestral a todos los lobos y los perros —entre el 11,3 % y el 13,6 %— y, en cantidades menores —hasta un 2,8 %— en las poblaciones de lobos modernos.[9][6]
Según los datos, todos los lobos experimentaron similares variaciones en sus poblaciones, seguidas por una disminución general de sus números coincidente con la expansión de los humanos modernos y el desarrollo de tecnologías para aumentar las capturas de caza mayor.[9][121] Los carnívoros del Pleistoceno tardío podrían haber vivido en manadas grandes para poder cazar los animales de gran tamaño existentes en aquel entonces, y estas manadas numerosas habrían sido blancos más visibles para los cazadores humanos.[121] Los perros grandes que acompañan a los seres humanos pueden haber contribuido a la disminución de los carnívoros que competían por la caza;[9][122] la domesticación de algunos grupos de lobos durante la expansión de los seres humanos por Eurasia podría haber causado así el declive de otros.[9]
El estudio concluyó que los cruces habían dificultado las deducción del lugar donde la domesticación del perro tuvo lugar. Las investigaciones anteriores podrían reflejar mezclas regionales entre perros y lobos y el flujo de genes entre poblaciones de perros, por lo que las razas de perros más divergentes mantendrían más contribuciones del lobo en su genoma. El estudio propuso que el análisis de ADN antiguo podría ser un mejor enfoque.[9]
En el mismo año, se descubrió que solo once genes fijos exhibían variaciones entre lobos y perros. Se cree que estos genes afectan a la docilidad y la capacidad de procesamiento emocional.[123] Otro estudio listó los haplotipos mitocondriales de todos los lobos grises y perros combinados en un solo árbol filogenético.[124]
En el año 2022 un estudió llevó a cabo la secuenciación de novo del genoma de 72 lobos agrupados a los largo de los últimos 100 000 años. Tras la generación de las bibliotecas genómicas correspondientes a estos individuos, estas se fusionaron junto con los genomas de otros 722 cánidos previamente analizados, entre los que se encontraban algunos perros. Los análisis bioinformáticos llevados a cabo con esta información revelaron un patrón migratorio unidireccional desde las zonas de Eurasia oriental, como Siberia, hacia el extremo occidental del continente. Sin embargo, el reemplazo poblacional parece no haber sido completo, pues la ascendencia profunda europea prevalece en el genoma de los cánidos actuales. Por otra parte, no parece existir ascendencia profunda en los actuales cánidos presentes en Norteamérica, pero sí remanentes genómicos procedentes del coyote. Estos hallazgos, junto con el rechazo de los análisis bioinformáticos con los modelos de ancestro único, han dado lugar a un modelo de doble ancestro para el perro.[7]
Lobo de Taimyr
En mayo de 2015, se examinó parte de una costilla de un ejemplar nombrado Taimyr-1 encontrada cerca del río Bolshaya Balajnaya en la península de Taimyr del Ártico al norte de Siberia,y cuya edad se estimó por radiocarbono en 34 900 años. De esta muestra se extrajo la primera secuencia del genoma nuclear de un carnívoro del Pleistoceno, depositada en el Archivo Europeo de Nucleótidos. El ejemplar fue clasificado como Canis lupus.[8]
Comparando la secuencia genética con la de un lobo moderno y tomando como base la datación por carbono-14, se calculó la tasa de mutación del genoma de los perros y lobos, un dato esencial para calcular el tiempo de divergencia entre las especies. Los datos indicaron que el hasta entonces desconocido linaje de Taimyr-1 constituía una población de lobos diferente a los lobos modernos y los perros, y su genotipo divergió de un ancestro común a las tres subespecies[8][63][125] antes del auge del último máximo glacial, hace 27 000-40 000 años. La separación del perro y lobo no tuvo que coincidir necesariamente con la cría selectiva por los seres humanos.[8][126] Una divergencia temprana es consistente con varios descubrimientos paleontológicos de cánidos similares a los perros de 36 000 años, así como indicios de que los perros domesticados probablemente acompañaron a los primeros colonizadores de las Américas.[8]
La comparación con el lobo gris sugirió que Taimyr-1 fue basal a los lobos grises procedentes de Oriente Medio, China, Europa y América del Norte, pero compartió una cantidad sustancial de la historia de los lobos grises modernos después de su separación de los coyotes. Esto implica que los ancestros de la mayoría de las poblaciones de lobos grises actuales tuvieron su origen en una población que existió hace menos de 35 000 años, pero antes de que la inundación del puente de tierra de Bering aislara entre sí a los lobos de Eurasia y América del Norte.[8] Una comparación de la ascendencia del linaje de Taimyr-1 y el del perro indica que algunas razas de perros modernos son más cercanas bien al lobo gris o al lobo de Taimyr-1, debido a la mezcla. El perro lobo de Saarloos está más emparentado con el lobo gris, en acuerdo con los datos históricos que documentan el cruce con los lobos grises de esta raza. Taimyr-1 comparte más alelos con razas de altas latitudes, como el husky siberiano y el perro de Groenlandia,[8][125] y en menor medida con el Shar Pei y el spitz finlandés.

El perro de Groenlandia dog comparte alrededor de 3,5 % de su genoma con el lobo de Taimyr aunque porcentajes entre un 1,4 y 27,3 % son consistentes con los datos. Estos resultados pueden explicarse por una presencia temprana de perros en el norte de Eurasia o por la presencia de los genes del lobo Taimyr en las poblaciones septentrionales de lobos, que se mezclarían con los perros posteriormente. Estos genes habrían sido beneficiosos para la adaptación de los perros al medio ambiente propio de latitudes altas. Los resultados también sugieren un origen multirregional de los antepasados de las razas de perros actuales.[8] Los intentos de determinar el grado de mezcla entre el ejemplar Taimyr-1 y los lobos grises no han producido resultados concluyentes.[8]
Canis variabilis
En 2015, se examinaron las secuencias de la región de control mitocondrial de los restos de trece cánidos antiguos y un lobo moderno provenientes de cinco sitios del Ártico al noreste de Siberia. Se encontraron nueve haplotipos mitocondriales, seis de los cuales eran desconocidos hasta entonces. El árbol filogenético generado a partir de estas secuencias reveló que cuatro de los cánidos de hace 28 000 años y un Canis c.f. variabilis con fecha de 360 000 años eran muy divergentes. El haplotipo designado como S805 de un ejemplar de 28 000 del río Yana presentaba una mutación adicional respecto al haplotipo S902, de 8000 años de antigüedad, que representa el clado A de los lobos modernos y perros domésticos. Este haplotipo es parecido a uno hallado en el lobo japonés, recientemente extinguido. Varios haplotipos ancestrales se disponen en torno a S805, entre ellos Canis c.f. variabilis de hace 360 000 años, el perro de Goyet de Bélgica fechado en 36 000 años, y sendos ejemplares provenientes de Bélgica (30 000 años) y Konsteki, Rusia (22 000 años). Dada la posición del haplotipo S805 en el árbol filogenético, esto puede representar un enlace potencialmente directo desde el progenitor (incluyendo Canis c.f. variabilis) con el perro doméstico y los linajes del lobo moderno. Se cree que el lobo gris es ancestro del perro doméstico, pero su relación con C. variabilis, y la contribución genética de C. variabilis al perro son objeto de debate.[127]
Los haplotipos de los cánidos de la isla Zhójov, de hace 8700 años y de Aachim (1700 años) pertenecen al clado del perro doméstico; se agrupan con S805, y también aparecen, a veces separados por una mutación, en el lobo tibetano y el lobo japonés, lo que sugiere que estos cánidos retuvieron la firma genética de la mezcla con las poblaciones de lobos regionales. Otro haplotipo designado como S504, datante de hace 47 000 años con procedencia de Duvanny Yar, apareció en el árbol filogenético sin conexión con los lobos antiguos o modernos, pero ancestral a los perros, y puede representar una fuente genética regional de los perros.[127]
Ascenso a depredador dominante
En 2015, un estudio examinó la paleoecología de grandes carnívoros de la estepa de mamuts durante el Pleistoceno tardío mediante el uso de análisis de isótopos estables del colágeno extraído de fósiles para reconstruir sus dietas. Según los exámenes, hace alrededor de 40 l000 años las hienas de las cavernas se alimentaban de mamuts, rinocerontes lanudos, caballos y renos, mientras que los leones de las cavernas cazaban renos y osos de las cavernas jóvenes. Los lobos no parecen haber podido competir con las hienas, pues su dieta estaba restringida a ciervos, ciervos gigantes y rebecos. Sin embargo, tras el Último Máximo Glacial hace alrededor de 14 000 años, los lobos tenían acceso a toda clase de presas, el león de las cavernas se alimentaba solo de renos, y la hiena de las cavernas se había extinguido.[128][129][130] Los datos sugieren que la extinción de la hienas de las cavernas permitió al lobo convertirse en el depredador dominante en lugar del león de las cavernas, justo antes de la extinción de esta última especie.[130]
Diferencias entre poblaciones de lobos
Los lobos grises existen en muchos hábitats diferentes, desde la tundra ártica hasta las estepas y desiertos y su área de distribución natural abarca todo el Holártico. Las diferencias genéticas entre las diferentes poblaciones de lobos grises están estrechamente vinculadas con el tipo de hábitat en el que viven.[5] Las diferencias en los marcadores genéticos entre los lobos escandinavos han surgido en poco más de una década, debido al pequeño tamaño de la población,[5][131] lo que indica que estas diferencias no dependen de un largo tiempo de aislamiento y que diferencias significativas pueden evolucionar en tan solo unos pocos miles de años.[5] Las diferencias pueden incluir el color del pelaje y el tamaño del cuerpo,[5][132][133] así como el comportamiento y la alimentación: por ejemplo, los lobos en zonas costeras se alimentan de peces,[5][132] y los lobos de la tundra emigran.[5][133] Estas diferencias aparecen incluso en poblaciones cercanas y se ha demostrado que los lobos de la montaña no se cruzan con los lobos de zonas costeras cercanas, y los Alpes de Francia y Suiza se han repoblado con los lobos de las montañas de Italia[5][134] y de las más lejanas montañas de Croacia[5][135] en vez de lobos de las tierras bajas cercanas, lo que indica que la distancia no es la fuerza motriz de las diferencias entre los dos ecomorfos.[5] Los factores ecológicos, incluyendo el tipo de hábitat, el clima, la especialización y la competencia depredadora tendrán gran influencia en la estructura genética de la población y la plasticidad cráneodental.[100][63][5][133][136][137][2][3][4] Dentro de la población de lobos grises del Pleistoceno, las variaciones entre los entornos locales habrían alentado una gama de ecotipos de lobos genéticamente, morfológicamente y ecológicamente distintos unos de otros.[63]
Ecotipos
En 2016, se compararon en dos estudios las secuencias de 42 000 polimorfismos de nucleótido único en lobos grises de América del Norte; se hallaron seis ecotipos o poblaciones con rasgos genéticos y ecológicos diferentes según el tipo de hábitat. La precipitación y temperatura diurna media fueron las variables más influyentes en las secuencias genéticas.[138][139] Estos resultados son consistentes con hallazgos previos de que la precipitación influencia la morfología,[140] y que la vegetación[2] y el tipo de hábitat[132][141] contribuyen a las diferencias entre los lobos. El estudio ha identificado 1040 genes potencialmente sometidos a la selección natural debido a variaciones del hábitat.[139] La adaptación local de un ecotipo refleja probablemente la preferencia de los lobos por el tipo de hábitat en que nacieron.[138]
Lobos del Pleistoceno
Los restos más antiguos de Canis en Europa, se encontraron en Francia y En Italia (Canis cf. etruscus) con edades respectivas de 3,1 y 2,2 millones de años.[142][143] El primer ejemplar de C. lupus se halló en Italia y data del estadio isotópico marino 9, de hace unos 337 000 años.[144] En Gran Bretaña, era la única especie de cánidos presentes hace 243 000 años, siendo los restos más antiguos los hallados en la cueva de Pontnewydd, en el norte de Gales.[145] Durante la era glacial, Gran Bretaña estaba separada de Europa tan solo por un río en lo que es hoy el Canal de la Mancha.
El C. lupus del Pleistoceno en Gran Bretaña tenía una gran plasticidad craneodental, que lo habilitaba para aplastar, cortar carne y comer huesos en respuesta a los cambios en la dieta a través del tiempo causados por diferentes condiciones climáticas y ecológicas. Estos cambios se dieron no solo a nivel local, sino de toda la especie. La supervivencia de C. lupus durante el Pleistoceno se puede atribuir en gran parte a la plasticidad de su morfología craneodental.[4]
Por otra parte, gracias a la gran amplitud temporal de los datos analizados en un estudio del año 2022 se pudieron detectar patrones de selección natural relacionados con la adaptación de la especie, lo cual podría explicar por qué no se extinguió durante el Último Máximo Glacial como pasó con muchas otras especies de mamíferos. Se encontraron 24 regiones genómicas con evidencia de selección natural, siendo las más destacables las halladas en el cromosoma 25, donde las variantes del gen IFT88 sufrieron un rápido aumento hace unos 30 000 años y se encuentran presentes en los perros actuales. También existen variaciones 2.5 Mb aguas abajo de este gen, en una región cuyo papel no se ha determinado, pero cuyo papel hipotético es la regulación del gen IFT88 a larga distancia. Por otra parte, también se detectaron variaciones en un cluster de genes olfatorios presentes en el cromosoma 15.[7]



| Tiempo | Variables |
|---|---|
| 243 000 MIS 7 | El paleoambiente consistía en praderas abiertas con temperaturas estivales entre 16 °C y 23 °C y temperaturas invernales entre -7 °C y -6 °C, donde pastaban mamuts y caballos. Los depredadores principales eran el león, el oso pardo, y, en ocasiones, la hiena manchada. Los lobos de este estadio eran ligeramente más pequeños que los lobos de MIS 5 y los lobos modernos en Suecia. Estos lobos sufrían la competencia de los carnívoros más grandes, lo que conllevaba una dieta más omnívora y una mayor capacidad de trituración en un entorno con más tipos de presas y más fuentes de alimentos que el período de MIS 5. Tenían mandíbulas menos profundas y más estrechas que los lobos de la etapa MIS 5 y los lobos modernos, indicio de que cazaban presas de tamaño pequeño a mediano. Mostraban un menor porcentaje de roturas de dientes que los lobos del estadio MIS 3. Sin embargo, experimentaban un mayor desgaste dental moderado.[4] |
| 82 000 MIS 5A | El paleoambiente era de tundra abierta, con temperaturas de verano oscilantes entre los 7 °C y 11 °C y temperaturas invernales de entre -10 °C y -30 °C. Las especies dominantes eran los renos y los bisontes. Una forma de oso pardo grande era el máximo depredador, y no había hienas. Los lobos de este estadio se caracterizaban por un tamaño corporal mayor que los lobos suecos actuales. Padecían un clima severo, una baja disponibilidad de presas, factores que les condujeron a una dieta más carnívora, con un aumento del consumo de carroñas, como cadáveres congelados, y huesos. Desarrollaron mandíbulas fuertes y una la capacidad máxima de corte de carne en comparación con los otros lobos, con mandíbulas menos profundas que el lobo moderno, pero más amplias y profundas que las de los ejemplares de los estadios MIS 7 y MIS 5. El cuarto premolar superior era largo y estrecho y poseía molares superiores 1 y 2 largos pero de anchura reducida, y por lo tanto menor capacidad de trituración, lo que indica hipercarnivorismo. Exhiben un mayor porcentaje de rotura de dientes y los dientes muy desgastados en comparación con los otros lobos; es posible que utilizaran el premolar 4 superior y el molar 1 inferior para aplastar huesos en vez de los molares, lo que conlleva mayores daños en la dentición.[4] |
| 57 000 MIS 3 | Las praderas abiertas habitadas por el mamut, el rinoceronte lanudo, el caballo y el ciervo gigante conformaban el paleoambiente, con una temperatura estival alrededor de los 12 °C y temperaturas invernales rondando los -20 °C. Entre las especies depredadoras se contaban el león, el oso pardo, y el carnívoro dominante, la hiena manchada. Los lobos de este estadio eran más pequeños que los lobos del estadio MIS 5 y los lobos modernos. Al igual que los lobos del estadio MIS 7, su dieta era más variada y cazaban presas de tamaño pequeño y mediano. El desgaste dental también era similar al de los lobos más antiguos.[4] |
| Lobos modernos (Suecia) | Aunque los lobos se han extinguido en Gran Bretaña, sobreviven en Suecia, donde las temperaturas son similares a las de Gran Bretaña durante el período MIS 7. El medio ambiente es de bosque boreal con temperaturas de verano entre los 14 y los 18 °C y temperaturas de invierno entre 1 y -10 °C. Los alces, renos, corzos, jabalíes, liebres, conejos y castores son los animales de presa predominantes; el lobo es el depredador superior. Estos lobos son de menor tamaño que los lobos del estadio MIS 5 pero más grandes que los de MIS 7 y MIS 3. La parte superior de los molares M1 y M2 es más larga que la de los lobos de MIS 7 y MIS 3, y las mandíbulas más amplias y profundas, consistente con la capacidad de cazar y de someter a las presas grande. Sin embargo, los molares mayores con capaces de triturar y procesar los alimentos no cárnicos. Las presas pequeñas y medianas son difíciles de detectar y cazar en los bosques boreales, lo que lleva a una adaptación para cazar más. Son hipercarnívoros similares a los lobos MIS 5, pero con menor capacidad de corte de la carne.[4] |
Durante el Último Máximo Glacial hace 20 000 años, la estepa del Pleistoceno se extendía a través de Eurasia septentrional y central y por Beringia hasta América del Norte. Los lobos del Pleistoceno de Beringia, y tal vez aquellos de la estepa, se adaptaron a este hábitat. La morfología de sus dientes y cráneos indica que se especializaron en aprovechar la ya extinta megafauna del Pleistoceno, y el desgaste de los dientes indica que su comportamiento era diferente al de los lobos modernos.[98][5][146][147] Esto resalta el éxito de C. lupus en la adaptación a diferentes condiciones ambientales.[4] Este lobo gris ecomorfo se extinguió al final de la glaciación, junto con el caballo y otras especies de la cual dependía, y fue reemplazado por los lobos del sur de América del Norte, evidencia de que los lobos ecomorfos especializados pueden extinguirse cuando su entorno cambia a pesar de que el hábitat es capaz de sutentar a otros lobos.[5] En la misma época la especie sufrió un cuello de botella poblacional,[103][6][63][5] lo que indica que los lobos Beringia no fueron los úncos en extinguirse.[5]
Se han encontrado algunos restos de Canis en la cueva Goyet, Bélgica, con una edad de 36 500 años,[99], en la cueva Razboinichya, Rusia, (33 500 años),[148] Kostenki 8, Rusia, (33 500-26 500 años),[149] Predmosti, República Checa, (31 000 años)[150] y Eliseevichi 1, Rusia, (17 000 años).[57] Estos ejemplares pueden ser perros del Paleolítico temprano, por sus características morfométricas craneales que se cree están asociadas con el proceso de la domesticación:[149] rostro acortado, apiñamiento de los dientes, y ausencia o rotación de los premolares, características que, por otra parte, se han documentado en ejemplares de lobos antiguos y modernos.[98][63][4][151][152][153] Por tanto, estos ejemplares también pueden representar una población de lobos morfológicamente diferenciada, en lugar de perros.[63][154]
Referencias
- ↑ Dawkins, William Boyd, Sir; Sanford, W. Ayshford; Reynolds, Sidney H. (1912). «British Pleistocene Hyænidæ, Ursidæ, Canidæ, and Mustelidæ». A Monograph of the British Pleistocene Mammalia 2. London: Palaeontographical Society.
- ↑ a b c Geffen, ELI; Anderson, Marti J.; Wayne, Robert K. (2004). «Climate and habitat barriers to dispersal in the highly mobile grey wolf». Molecular Ecology 13 (8): 2481-90. PMID 15245420. doi:10.1111/j.1365-294X.2004.02244.x.
- ↑ a b Pilot, Malgorzata; Jedrzejewski, Wlodzimierz; Branicki, Wojciech; Sidorovich, Vadim E.; Jedrzejewska, Bogumila; Stachura, Krystyna; Funk, Stephan M. (2006). «Ecological factors influence population genetic structure of European grey wolves». Molecular Ecology 15 (14): 4533-53. PMID 17107481. doi:10.1111/j.1365-294X.2006.03110.x.
- ↑ a b c d e f g h i Flower, Lucy O.H.; Schreve, Danielle C. (2014). «An investigation of palaeodietary variability in European Pleistocene canids». Quaternary Science Reviews 96: 188-203. doi:10.1016/j.quascirev.2014.04.015.
- ↑ a b c d e f g h i j k l m n ñ Leonard, Jennifer (2014). «Ecology drives evolution in grey wolves». Evolution Ecology Research 16: 461-473. Archivado desde el original el 15 de abril de 2016. Consultado el 8 de octubre de 2016.
- ↑ a b c d e f g h i j k l m n Freedman, Adam H.; Gronau, Ilan; Schweizer, Rena M.; Ortega-Del Vecchyo, Diego; Han, Eunjung; Silva, Pedro M.; Galaverni, Marco; Fan, Zhenxin; Marx, Peter; Lorente-Galdos, Belen; Beale, Holly; Ramirez, Oscar; Hormozdiari, Farhad; Alkan, Can; Vilà, Carles; Squire, Kevin; Geffen, Eli; Kusak, Josip; Boyko, Adam R.; Parker, Heidi G.; Lee, Clarence; Tadigotla, Vasisht; Siepel, Adam; Bustamante, Carlos D.; Harkins, Timothy T.; Nelson, Stanley F.; Ostrander, Elaine A.; Marques-Bonet, Tomas; Wayne, Robert K. et al. (2014). «Genome Sequencing Highlights the Dynamic Early History of Dogs». PLoS Genetics 10 (1): e1004016. PMC 3894170. PMID 24453982. doi:10.1371/journal.pgen.1004016.
- ↑ a b c d e Bergström, Anders; Stanton, David W. G.; Taron, Ulrike H.; Frantz, Laurent; Sinding, Mikkel-Holger S.; Ersmark, Erik; Pfrengle, Saskia; Cassatt-Johnstone, Molly et al. (14 de julio de 2022). «Grey wolf genomic history reveals a dual ancestry of dogs». Nature (en inglés) 607 (7918): 313-320. ISSN 0028-0836. PMC 9279150. PMID 35768506. doi:10.1038/s41586-022-04824-9. Consultado el 7 de diciembre de 2022.
- ↑ a b c d e f g h i j k l m Skoglund, P. (2015). «Ancient wolf genome reveals an early divergence of domestic dog ancestors and admixture into high-latitude breeds». Current Biology 25 (11): 1515-9. PMID 26004765. doi:10.1016/j.cub.2015.04.019.
- ↑ a b c d e f g h i j k l m n ñ o p q r s Fan, Zhenxin; Silva, Pedro; Gronau, Ilan; Wang, Shuoguo; Armero, Aitor Serres; Schweizer, Rena M.; Ramirez, Oscar; Pollinger, John; Galaverni, Marco; Ortega Del-Vecchyo, Diego; Du, Lianming; Zhang, Wenping; Zhang, Zhihe; Xing, Jinchuan; Vilà, Carles; Marques-Bonet, Tomas; Godinho, Raquel; Yue, Bisong; Wayne, Robert K. (2016). «Worldwide patterns of genomic variation and admixture in gray wolves». Genome Research 26 (2): 163-73. PMID 26680994. doi:10.1101/gr.197517.115.
- ↑ a b Sardella, Raffaele; Bertè, Davide; Iurino, Dawid Adam; Cherin, Marco; Tagliacozzo, Antonio (2014). «The wolf from Grotta Romanelli (Apulia, Italy) and its implications in the evolutionary history of Canis lupus in the Late Pleistocene of Southern Italy». Quaternary International. 328-329: 179-195. doi:10.1016/j.quaint.2013.11.016.
- ↑ Flynn, John J.; Wesley-Hunt, Gina D. (2005). «Phylogeny of the Carnivora: Basal Relationships Among the Carnivoramorphans, and Assessment of the Position of 'Miacoidea' Relative to Carnivora». Journal of Systematic Paleontology 3: 1-28.
- ↑ «Eucyon davisi». Fossilworks. Archivado desde el original el 27 de julio de 2020. Consultado el 11 de julio de 2016.
- ↑ a b c d e f g h i j k l Wang, Xiaoming; Tedford, Richard H.; Dogs: Their Fossil Relatives and Evolutionary History. New York: Columbia University Press, 2008.
- ↑ a b c d e f g h i j k l m n ñ o p q r R.M. Nowak (2003). «Chapter 9 - Wolf evolution and taxonomy». En Mech, L. David; Boitani, Luigi, eds. Wolves: Behaviour, Ecology and Conservation. University of Chicago Press. pp. 239–258. ISBN 978-0-226-51696-7.
- ↑ a b c d e f g h i j k Nowak, R. M. (1979). North American Quaternary Canis 6 (6). Monograph of the Museum of Natural History, University of Kansas. pp. 1-154. ISBN 978-0-89338-007-6.
- ↑ Wayne, R. K. (1995). «Red wolf: To conserve or not to conserve». En Macdonald, D.; Handoca, L., eds. Canid News 3. Newsletter of the IUCN/SSC Specialist Group. pp. 7-12.
- ↑ «Canis lepophagus». Fossilworks. Archivado desde el original el 21 de enero de 2016. Consultado el 11 de julio de 2016.
- ↑ a b Kurten, B. (1974). «A History of Coyote-Like Dogs (Canidae, Mamalia)». Acta zoologica Fennica (140): 1-38.
- ↑ a b c d Kurten, B.; Anderson, E. (1980). Pleistocene mammals of North America. New York: Columbia University Press. pp. 1–442. ISBN 978-0-231-03733-4.
- ↑ a b Johnston, C. S. (1938). «Preliminary report on the vertebrate type locality of Cita Canyon and the description of an ancestral coyote». American Journal of Science. 5 35 (209): 383-390. doi:10.2475/ajs.s5-35.209.383.
- ↑ a b c d e f g h i j k l m Tedford, Richard H.; Wang, Xiaoming; Taylor, Beryl E. (2009). «Phylogenetic Systematics of the North American Fossil Caninae (Carnivora: Canidae)». Bulletin of the American Museum of Natural History 325: 1-218. doi:10.1206/574.1. Archivado desde el original el 25 de mayo de 2017. Consultado el 8 de octubre de 2016.
- ↑ a b Tedford, R.H. & Qiu, Z.-X., 1996 - A new canid genus from the Pliocene of Yushe, Shanxi Province - Vertebrata PalAsiatica 34 (1): 27-40
- ↑ Anderson, E. (1996). «A preliminary report on the Carnivora of Porcupine Cave, Park County, Colorado». En Churcher, C. S. R.; Stewart, K. M.; Seymour, K. L., eds. Palaeoecology and palaeoenvironments of late Cenozoic mammals. Toronto: University of Toronto Press. pp. 259-282. ISBN 978-0-8020-0728-5.
- ↑ Albright, III, L. B. (2000). Biostratigraphy and Vertebrate Paleontology of the San Timoteo Badlands, Southern California. University of California Publications in Geological Sciences 144. University of California Press. pp. 1-121. ISBN 978-0-520-91598-5.
- ↑ «Canis edwardii». Fossilworks. Archivado desde el original el 8 de marzo de 2016. Consultado el 11 de julio de 2016.
- ↑ Berta, A. (1995). «Fossil carnivores from the Leisey Shell Pits, Hillsborough County, Florida». En Hulbert, Jr., R. C.; Morgan, G. S.; Webb, S. D., eds. Paleontology and geology of the Leisey Shell Pits, early Pleistocene of Florida 37. Bulletin of the Florida Museum of Natural History. pp. 463-499.
- ↑ «Canis ambrusteri». Fossilworks. Consultado el 11 de julio de 2016.
- ↑ Martin, R. A.; Webb, S. D. (1974). «Late Pleistocene mammals from the Devil's Den fauna, Levy County». En Webb, S. D., ed. Pleistocene Mammals of Florida. Gainesville: University Presses of Florida. pp. 114–145. ISBN 978-0-8130-0361-0.
- ↑ Kurten, B. 19800Geographic differentiation in the Rancholabrean dire wolf (Canis dirus Leidy) in North America. In Genoways, H. H. & Dawson, M. R. (eds.): Contributions in Quaternary Vertebrate Paleontology: A Volume in Memorial to John E. Guilday, 218–227. Carnegie Museum of Natural History Special Publication 8
- ↑ «Canis dirus». Fossilworks. Archivado desde el original el 29 de junio de 2017. Consultado el 11 de julio de 2016.
- ↑ Goulet, G. D. (1993). Comparison of temporal and geographical skull variation among Nearctic, modern, Holocene, and late Pleistocene gray wolves (Canis lupus) and selected Canis (Master's Degree). Winnipeg: University of Manitoba. pp. 1-116.
- ↑ Berta, A. (1988). Quaternary evolution and biogeography of the large South American Canidae (Mammalia: Carnivora) 132. University of California Publications in Geological Sciences. pp. 1-49. ISBN 978-0-520-09960-9.
- ↑ Nowak, R. M.; Federoff, N. E. (2002). «The systematic status of the Italian wolf Canis lupus». Acta theriol 47 (3): 333-338. doi:10.1007/BF03194151.
- ↑ a b c Kurtén, B. (1968). Pleistocene mammals of Europe. London: Weidenfeld and Nicolson. p. 317. ISBN 978-0-202-30953-8.
- ↑ a b Sotnikova, M (2010). «Dispersal of the Canini (Mammalia, Canidae: Caninae) across Eurasia during the Late Miocene to Early Pleistocene». Quaternary International 212 (2): 86-97. doi:10.1016/j.quaint.2009.06.008.
- ↑ Nowak, R. M. (1995). «Another look at wolf taxonomy». En Carbyn, L. H.; Fritts, S. H.; Seip, D. R., eds. Ecology and Conservation of Wolves in a Changing World. Edmonton, Canada: Canadian Circumpolar Institute. pp. 375-397. ISBN 978-0-919058-92-7.
- ↑ Torre, D. (1967). «I cani Villafranchiani della Toscana». Palaeontographia Italica (en italiano) 63: 113-136.
- ↑ Torre, D. (1974). «Affinità dentali del cane della grotta di l’Escale». Rivista Italiana di Paleontologia e Stratigrafia (en italiano) 80: 147-156.
- ↑ Torre, D. (1979). «The Ruscinian and Villafranchian dogs of Europe». Bollettino della Società Paleontologica Italiana (en italiano) 18: 162-165.
- ↑ Martin, R. (1973). «Trois nouvelles espèces de Caninae (Canidae, Carnivora) des gisements Plio-Villafranchiens d’Europe. Documents des Laboratoires de Géologie de Lyon». Notes et Mémoires (en francés) 57: 87-96.
- ↑ Sotnikova, M. (1989). «The carnivore mammals from the Pliocene to the early Pleistocene. Stratigraphic significance». Transactions of the Geological Institute of RAS 440: 1-122.
- ↑ Rook, L. (1993). I cani dell’Eurasia dal Miocene superiore al Pleistocene medio (Ph.D.). Universities of Modena, Bologna, Firenze, Roma “La Sapienza”, Italy.
- ↑ Sotnikova, M. (2001). «Remains of Canidae from the Lower Pleistocene site of Untermassfeld». En Kahlke, R. D., ed. Das Plestozan von Untermassfled bei Meiningen (Thuringen), part 2 40. Romisch-Germanisches Zentralmuseum. pp. 607-632. ISBN 978-3-7749-3080-3.
- ↑ Brugal, J. P.; Boudadi-Maligne, M. (2011). «Quaternary small to large canids in Europe: taxonomic status and biochronological contribution». Quaternary International 243: 171-182. doi:10.1016/j.quaint.2011.01.046.
- ↑ Cherin, M.; Bertè, D. F.; Sardella, R.; Rook, L. (2013). «Canis etruscus (Canidae, Mammalia) and its role in the faunal assemblage from Pantalla (Perugia, central Italy): comparison with the Late Villafranchian large carnivore guild of Italy». Bollettino della Società Paleontologica Italiana 52 (1): 11-18. doi:10.4435/BSPI.2013.05.
- ↑ Cherin, Marco; Bertè, Davide; Rook, Lorenzo; Sardella, Raffaele (2014). «Re-Defining Canis etruscus (Canidae, Mammalia): A New Look into the Evolutionary History of Early Pleistocene Dogs Resulting from the Outstanding Fossil Record from Pantalla (Italy)». Journal of Mammalian Evolution 21 (1): 95-110. doi:10.1007/s10914-013-9227-4.
- ↑ Lumley, H. de, Kahlke, H.D., Moigne, A.M., Moulle, P.E., 1988. Les faunes de grands mammifères de la grotte du Vallonnet Roquebrune-Cap-Martin, Alpes-Maritimes. L’Anthropologie 92, 465–496.
- ↑ Soergel, W., 1928. Ein Kleiner Wolf aus dem Kiesen von Süssenborn. Zeitschrift der Deutschen Geologische Gesellschaft 80, 227–255.
- ↑ Garrido, Guiomar; Arribas, Alfonso (2008). «Canis accitanus nov. sp., a new small dog (Canidae, Carnivora, Mammalia) from the Fonelas P-1 Plio-Pleistocene site (Guadix basin, Granada, Spain)». Geobios 41 (6): 751-761. doi:10.1016/j.geobios.2008.05.002.
- ↑ a b
- ↑ a b New remains of Canis chihliensis (Mammalia, Carnivora) from Shanshenmiaozui, a lower Pleistocene site in Yangyuan, Hebei Archivado el 19 de septiembre de 2016 en Wayback Machine. Tong, H.-w., N. Hu, and X. Wang. 2012. Vertebrata PalAsiatica 50(4):335-360
- ↑ a b c d e f g h i Koler-Matznick, Janice (2002). «The origin of the dog revisited». Anthrozoos: A Multidisciplinary Journal of the Interactions of People & Animals 15 (2): 98. doi:10.2752/089279302786992595. Archivado desde el original el 23 de octubre de 2014. Consultado el 8 de octubre de 2016.
- ↑ Olsen, S. J. (1985). Origins of the domestic dog: the fossil record. Univ. of Arizona Press, Tucson, USA. pp. 88-89.
- ↑ Olsen S J, Olsen J W, Qi G Q, 1982. The position of Canis lupus variabilis, from Zhoukoudian, in the ancestral lineage of the domestic dog, Canis familiaris. Vert PalAsia, 20(3): 264-267(in Chinese with last page abstract in English)
- ↑ Lawrence, B. 1967. Early domestic dogs. Zeitschrift für Säugetierkunde 32: 44 – 59.
- ↑ Pei, W.C. (1934). The carnivora from locality 1 of Choukoutien. Palaeontologia Sinica, Series C, vol. 8, Fascicle 1. Geological Survey of China, Beijing. pp. 1-45. Archivado desde el original el 6 de junio de 2015. Consultado el 8 de octubre de 2016.
- ↑ a b Sablin, Mikhail V.; Khlopachev, Gennady A. (2002). The Earliest Ice Age Dogs:Evidence from Eliseevichi I. Wenner-Gren Foundation for Anthropological Research. Consultado el 10 de enero de 2015.
- ↑ a b c d e f g h i j Thalmann, O.; Shapiro, B.; Cui, P.; Schuenemann, V. J.; Sawyer, S. K.; Greenfield, D. L.; Germonpre, M. B.; Sablin, M. V.; Lopez-Giraldez, F.; Domingo-Roura, X.; Napierala, H.; Uerpmann, H.-P.; Loponte, D. M.; Acosta, A. A.; Giemsch, L.; Schmitz, R. W.; Worthington, B.; Buikstra, J. E.; Druzhkova, A.; Graphodatsky, A. S.; Ovodov, N. D.; Wahlberg, N.; Freedman, A. H.; Schweizer, R. M.; Koepfli, K.- P.; Leonard, J. A.; Meyer, M.; Krause, J.; Paabo, S. et al. (2013). «Complete Mitochondrial Genomes of Ancient Canids Suggest a European Origin of Domestic Dogs». Science 342 (6160): 871-4. PMID 24233726. doi:10.1126/science.1243650.
- ↑ a b c Morey, Darcy F.; Jeger, Rujana (2015). «Paleolithic dogs: Why sustained domestication then?». Journal of Archaeological Science: Reports 3: 420. doi:10.1016/j.jasrep.2015.06.031.
- ↑ Wayne, Robert K. (1986). «Cranial Morphology of Domestic and Wild Canids: The Influence of Development on Morphological Change». Evolution 40 (2): 243. JSTOR 2408805. doi:10.2307/2408805.
- ↑ Drake, Abby Grace; Klingenberg, Christian Peter (2010). «Large‐Scale Diversification of Skull Shape in Domestic Dogs: Disparity and Modularity». The American Naturalist 175 (3): 289. PMID 20095825. doi:10.1086/650372.
- ↑ Roberts, Taryn; McGreevy, Paul; Valenzuela, Michael (2010). «Human Induced Rotation and Reorganization of the Brain of Domestic Dogs». PLoS ONE 5 (7): e11946. PMID 20668685. doi:10.1371/journal.pone.0011946.
- ↑ a b c d e f g Perri, Angela (2016). «A wolf in dog's clothing: Initial dog domestication and Pleistocene wolf variation». Journal of Archaeological Science 68: 1-4. doi:10.1016/j.jas.2016.02.003.
- ↑ Rand, David M. (2001). «The Units of Selection on Mitochondrial DNA». Annual Review of Ecology and Systematics 32: 415-448. doi:10.1146/annurev.ecolsys.32.081501.114109.
- ↑ a b c d e f g h Robert K. Wayne, Jennifer A. Leonard, Carles Vila (2006). «Chapter 19:Genetic Analysis of Dog Domestication». En Melinda A. Zeder, ed. Documenting Domestication:New Genetic and Archaeological Paradigms. University of California Press. pp. 279-295. ISBN 978-0-520-24638-6.
- ↑ Hofreiter, Michael; Serre, David; Poinar, Hendrik N.; Kuch, Melanie; Pääbo, Svante (2001). «Ancient DNA». Nature Reviews Genetics 2 (5): 353-9. PMID 11331901. doi:10.1038/35072071.
- ↑ Li, Wen-Hsiung (1997). Molecular evolution. Sunderland, Massachusetts: Sinauer Associates. ISBN 978-0-87893-463-8.[página requerida]
- ↑ Pesole, G; Gissi, C; De Chirico, A; Saccone, C (1999). «Nucleotide substitution rate of mammalian mitochondrial genomes». Journal of Molecular Evolution 48 (4): 427-34. PMID 10079281. doi:10.1007/pl00006487.
- ↑ Wan, Qiu-Hong; Wu, Hua; Fujihara, Tsutomu; Fang, Sheng-Guo (2003). «Which genetic marker for which conservation genetics issue?». Electrophoresis 25 (14): 2165. PMID 15274000. doi:10.1002/elps.200305922.
- ↑ Birky, C. William (2001). «The Inheritance of Genes in Mitochondria and Chloroplasts: Laws, Mechanisms, and Models». Annual Review of Genetics 35: 125-48. PMID 11700280. doi:10.1146/annurev.genet.35.102401.090231.
- ↑ Avise, J. C. (1994). Molecular Markers, Natural History, and Evolution. New York: Chapman & Hall. ISBN 978-0-412-03781-8.
- ↑ Avise, J. C. (2000). Phylogeography: The History and Formation of Species. Cambridge, Massachusetts: Harvard University Press. ISBN 978-0-674-66638-2.
- ↑ Tedford, Richard H.; Wang, Xiaoming; Taylor, Beryl E. (2009). «Phylogenetic Systematics of the North American Fossil Caninae (Carnivora: Canidae)». Bulletin of the American Museum of Natural History 325: 1-218. doi:10.1206/574.1.
- ↑ a b c d e Vila, C. (1997). «Multiple and ancient origins of the domestic dog». Science 276 (5319): 1687-9. PMID 9180076. doi:10.1126/science.276.5319.1687.
- ↑ a b c d Wayne, R. & Ostrander, Elaine A. (1999). «Origin, genetic diversity, and genome structure of the domestic dog». BioEssays 21 (3): 247-57. PMID 10333734. doi:10.1002/(SICI)1521-1878(199903)21:3<247::AID-BIES9>3.0.CO;2-Z.
- ↑ Boyko, A. (2009). «Complex population structure in African village dogs and its implications for inferring dog domestication history». Proceedings of the National Academy of Sciences 106 (33): 13903-13908. PMC 2728993. PMID 19666600. doi:10.1073/pnas.0902129106.
- ↑ a b Cronin, M. A.; Canovas, A.; Bannasch, D. L.; Oberbauer, A. M.; Medrano, J. F. (2014). «Single Nucleotide Polymorphism (SNP) Variation of Wolves (Canis lupus) in Southeast Alaska and Comparison with Wolves, Dogs, and Coyotes in North America». Journal of Heredity 106 (1): 26-36. PMID 25429025. doi:10.1093/jhered/esu075.
- ↑ Gray, Melissa M; Sutter, Nathan B; Ostrander, Elaine A; Wayne, Robert K (2010). «The IGF1 small dog haplotype is derived from Middle Eastern grey wolves». BMC Biology 8: 16. PMC 2837629. PMID 20181231. doi:10.1186/1741-7007-8-16.
- ↑ Wayne, Robert K.; Vonholdt, Bridgett M. (2012). «Evolutionary genomics of dog domestication». Mammalian Genome 23 (1–2): 3-18. PMID 22270221. doi:10.1007/s00335-011-9386-7.
- ↑ a b c d Lindblad-Toh, K.; Wade, C. M.; Mikkelsen, T. S.; Karlsson, E. K.; Jaffe, D. B.; Kamal, M.; Clamp, M.; Chang, J. L.; Kulbokas, E. J.; Zody, M. C.; Mauceli, E.; Xie, X.; Breen, M.; Wayne, R. K.; Ostrander, E. A.; Ponting, C. P.; Galibert, F.; Smith, D. R.; Dejong, P. J.; Kirkness, E.; Alvarez, P.; Biagi, T.; Brockman, W.; Butler, J.; Chin, C. W.; Cook, A.; Cuff, J.; Daly, M. J.; Decaprio, D. et al. (2005). «Genome sequence, comparative analysis and haplotype structure of the domestic dog». Nature 438 (7069): 803-819. Bibcode:2005Natur.438..803L. PMID 16341006. doi:10.1038/nature04338.
- ↑ Frantz, L. A. F.; Mullin, V. E.; Pionnier-Capitan, M.; Lebrasseur, O.; Ollivier, M.; Perri, A.; Linderholm, A.; Mattiangeli, V.; Teasdale, M. D.; Dimopoulos, E. A.; Tresset, A.; Duffraisse, M.; McCormick, F.; Bartosiewicz, L.; Gal, E.; Nyerges, E. A.; Sablin, M. V.; Brehard, S.; Mashkour, M.; b l Escu, A.; Gillet, B.; Hughes, S.; Chassaing, O.; Hitte, C.; Vigne, J.-D.; Dobney, K.; Hanni, C.; Bradley, D. G.; Larson, G. (2016). «Genomic and archaeological evidence suggest a dual origin of domestic dogs». Science 352 (6290): 1228-31. PMID 27257259. doi:10.1126/science.aaf3161.
- ↑ a b Wayne, R. (1993). «Molecular evolution of the dog family». Trends in Genetics 9 (6): 218-24. PMID 8337763. doi:10.1016/0168-9525(93)90122-X.
- ↑ Wurster-Hill, D. H.; Centerwall, W. R. (1982). «The interrelationships of chromosome banding patterns in canids, mustelids, hyena, and felids». Cytogenetics and Cell Genetics 34: 178-192. PMID 7151489. doi:10.1159/000131806.
- ↑ Gottelli, D.; Sillero-Zubiri, C.; Applebaum, G. D.; Roy, M. S.; Girman, D. J.; Garcia-Moreno, J.; Ostrander, E. A.; Wayne, R. K. (1994). «Molecular genetics of the most endangered canid: The Ethiopian wolf Canis simensis». Molecular Ecology 3 (4): 301-12. PMID 7921357. doi:10.1111/j.1365-294X.1994.tb00070.x.
- ↑ Pocock, R. I. (1941). Fauna of British India: Mammals 2. Taylor & Francis. pp. 146-163.
- ↑ Girman, D. J.; Vilà, C.; Geffen, E.; Creel, S.; Mills, M. G. L.; McNutt, J. W.; Ginsberg, J.; Kat, P. W.; Mamiya, K. H.; Wayne, R. K. (2001). «Patterns of population subdivision, gene flow and genetic variability in the African wild dog (Lycaon pictus)». Molecular Ecology 10 (7): 1703-23. PMID 11472538. doi:10.1046/j.0962-1083.2001.01302.x.
- ↑ Wayne, R.K.; Meyer, A.; Lehman, N.; van Valkeburgh, B.; Kat, P.W.; Fuller, T.K.; Girman, D.; O'Brien, S.J. (1990). «Large sequence divergence among mitochondrial DNA genotypes within populations of eastern African black-backed jackals». Proceedings of the National Academy of Sciences of the United States of America 87: 1772-1776. doi:10.1073/pnas.87.5.1772. Consultado el 21 de diciembre de 2011.
- ↑ Juliane Kaminski and Sarah Marshall-Pescini (2014). «Chapter 1 - The Social Dog:History and Evolution». The Social Dog:Behavior and Cognition. Elsevier. p. 4. ISBN 978-0-12407-931-1.
- ↑ Cox, C. B.; Moore, Peter D.; Ladle, Richard (2016). Biogeography: An Ecological and Evolutionary Approach. Wiley-Blackwell. p. 106. ISBN 978-1-118-96858-1.
- ↑ Editorial Board (2012). Concise Dictionary of Science. New Delhi: V&S Publishers. p. 137. ISBN 978-93-81588-64-2.
- ↑ Arora, Devender; Singh, Ajeet; Sharma, Vikrant; Bhaduria, Harvendra Singh; Patel, Ram Bahadur (2015). «Hgs Db: Haplogroups Database to understand migration and molecular risk assessment». Bioinformation 11 (6): 272-5. PMC 4512000. PMID 26229286. doi:10.6026/97320630011272.
- ↑ «Genetics Glossary». International Society of Genetic Genealogy. 2015. Consultado el 22 de julio de 2016.
- ↑ a b c d e f g h i j k l m n ñ Pilot, M. (2010). «Phylogeographic history of grey wolves in Europe». BMC Evolutionary Biology 10: 104. PMC 2873414. PMID 20409299. doi:10.1186/1471-2148-10-104.
- ↑ Aggarwal, R. K.; Kivisild, T.; Ramadevi, J.; Singh, L. (2007). «Mitochondrial DNA coding region sequences support the phylogenetic distinction of two Indian wolf species». Journal of Zoological Systematics and Evolutionary Research 45 (2): 163-172. doi:10.1111/j.1439-0469.2006.00400.x.
- ↑ Sharma, D. K.; Maldonado, J. E.; Jhala, Y. V.; Fleischer, R. C. (2004). «Ancient wolf lineages in India». Proceedings of the Royal Society B: Biological Sciences 271 (Suppl 3): S1-S4. PMC 1809981. PMID 15101402. doi:10.1098/rsbl.2003.0071.
- ↑ a b c Randi, Ettore (2011). «Genetics and conservation of wolves Canis lupus in Europe». Mammal Review 41 (2): 99-111. doi:10.1111/j.1365-2907.2010.00176.x.
- ↑ Tamm, E.; Kivisild, T.; Reidla, M.; Metspalu, M.; Smith, D. G.; Mulligan, C. J.; Bravi, C. M.; Rickards, O.; Martinez-Labarga, C.; Khusnutdinova, E. K.; Fedorova, S. A.; Golubenko, M. V.; Stepanov, V. A.; Gubina, M. A.; Zhadanov, S. I.; Ossipova, L. P.; Damba, L.; Voevoda, M. I.; Dipierri, J. E.; Villems, R.; Malhi, R. S. (2007). «Beringian Standstill and Spread of Native American Founders». En Carter, Dee, ed. PLoS ONE 2 (9): e829. PMC 1952074. PMID 17786201. doi:10.1371/journal.pone.0000829.
- ↑ a b c d e f g Leonard, J. A.; Vilà, C; Fox-Dobbs, K; Koch, P. L.; Wayne, R. K.; Van Valkenburgh, B (2007). «Megafaunal extinctions and the disappearance of a specialized wolf ecomorph». Current Biology 17 (13): 1146-50. PMID 17583509. doi:10.1016/j.cub.2007.05.072. Archivado desde el original el 28 de diciembre de 2016. Consultado el 8 de octubre de 2016.
- ↑ a b Germonpré, Mietje; Sablin, Mikhail V.; Stevens, Rhiannon E.; Hedges, Robert E.M.; Hofreiter, Michael; Stiller, Mathias; Despre´s, Viviane R. (2009). «Fossil dogs and wolves from Palaeolithic sites in Belgium, the Ukraine and Russia: osteometry, ancient DNA and stable isotopes». Journal of Archaeological Science 36 (2): 473-490. doi:10.1016/j.jas.2008.09.033.
- ↑ a b Hofreiter, Michael; Barnes, Ian (2010). «Diversity lost: Are all Holarctic large mammal species just relict populations?». BMC Biology 8: 46. PMC 2858106. PMID 20409351. doi:10.1186/1741-7007-8-46.
- ↑ Germonpré, Mietje; Sablin, Mikhail V.; Després, Viviane; Hofreiter, Michael; Lázničková-Galetová, Martina; Stevens, Rhiannon E.; Stiller, Mathias (2013). «Palaeolithic dogs and the early domestication of the wolf: A reply to the comments of Crockford and Kuzmin (2012)». Journal of Archaeological Science 40: 786-792. doi:10.1016/j.jas.2012.06.016.
- ↑ a b c Hofreiter, Michael (2007). «Pleistocene Extinctions: Haunting the Survivors». Current Biology 17 (15): R609-11. PMID 17686436. doi:10.1016/j.cub.2007.06.031.
- ↑ a b c Pilot, M; Greco, C; Vonholdt, B M; Jędrzejewska, B; Randi, E; Jędrzejewski, W; Sidorovich, V E; Ostrander, E A et al. (2013). «Genome-wide signatures of population bottlenecks and diversifying selection in European wolves». Heredity 112 (4): 428-42. PMID 24346500. doi:10.1038/hdy.2013.122.
- ↑ a b c Ersmark, Erik; Klütsch, Cornelya F. C.; Chan, Yvonne L.; Sinding, Mikkel-Holger S.; Fain, Steven R.; Illarionova, Natalia A.; Oskarsson, Mattias; Uhlén, Mathias; Zhang, Ya-Ping; Dalén, Love; Savolainen, Peter (2016). «From the Past to the Present: Wolf Phylogeography and Demographic History Based on the Mitochondrial Control Region». Frontiers in Ecology and Evolution 4. doi:10.3389/fevo.2016.00134.
- ↑ a b c d e f g h i j Koblmüller, Stephan; Vilà, Carles; Lorente-Galdos, Belen; Dabad, Marc; Ramirez, Oscar; Marques-Bonet, Tomas; Wayne, Robert K.; Leonard, Jennifer A. (2016). «Whole mitochondrial genomes illuminate ancient intercontinental dispersals of grey wolves (Canis lupus)». Journal of Biogeography. doi:10.1111/jbi.12765.
- ↑ Weckworth, Byron V.; Talbot, Sandra; Sage, George K.; Person, David K.; Cook, Joseph (2005). «A Signal for Independent Coastal and Continental histories among North American wolves». Molecular Ecology 14 (4): 917. PMID 15773925. doi:10.1111/j.1365-294X.2005.02461.x.
- ↑ Weckworth, Byron V.; Talbot, Sandra L.; Cook, Joseph A. (2010). «Phylogeography of wolves (Canis lupus) in the Pacific Northwest». Journal of Mammalogy 91 (2): 363. doi:10.1644/09-MAMM-A-036.1.
- ↑ Weckworth, Byron V.; Dawson, Natalie G.; Talbot, Sandra L.; Flamme, Melanie J.; Cook, Joseph A. (2011). «Going Coastal: Shared Evolutionary History between Coastal British Columbia and Southeast Alaska Wolves (Canis lupus)». PLoS ONE 6 (5): e19582. PMID 21573241. doi:10.1371/journal.pone.0019582.
- ↑ a b Vonholdt, B. M.; Cahill, J. A.; Fan, Z.; Gronau, I.; Robinson, J.; Pollinger, J. P.; Shapiro, B.; Wall, J. et al. (2016). «Whole-genome sequence analysis shows that two endemic species of North American wolf are admixtures of the coyote and gray wolf». Science Advances 2 (7): e1501714. doi:10.1126/sciadv.1501714.
- ↑ a b c d Matsumura, Shuichi; Inoshima, Yasuo; Ishiguro, Naotaka (2014). «Reconstructing the colonization history of lost wolf lineages by the analysis of the mitochondrial genome». Molecular Phylogenetics and Evolution 80: 105-12. PMID 25132126. doi:10.1016/j.ympev.2014.08.004.
- ↑ Abe, H. (1999). «Diversity and conservation of mammals of Japan». En Yokohata, Y.; Nakamura, S., eds. Recent Advances in the Biology of Japanese Insectivore. Shōbara: Hiba Society of Natural History. pp. 89-104.
- ↑ Ishiguro, Naotaka; Inoshima, Yasuo; Shigehara, Nobuo; Ichikawa, Hideo; Kato, Masaru (2010). «Osteological and Genetic Analysis of the Extinct Ezo Wolf (Canis Lupus Hattai) from Hokkaido Island, Japan». Zoological Science 27 (4): 320-4. PMID 20377350. doi:10.2108/zsj.27.320.
- ↑ Walker, Brett (2008). The Lost Wolves of Japan. University of Washington Press. p. 42.
- ↑ a b c Ishiguro, Naotaka; Inoshima, Yasuo; Shigehara, Nobuo (2009). «Mitochondrial DNA Analysis of the Japanese Wolf (Canis lupus hodophilax Temminck, 1839) and Comparison with Representative Wolf and Domestic Dog Haplotypes». Zoological Science 26 (11): 765-70. PMID 19877836. doi:10.2108/zsj.26.765.
- ↑ Morell, Virginia (2016). «How do you save a wolf that's not really a wolf?». Science 353 (6300). doi:10.1126/science.aag0699.
- ↑ Vila, C.; Amorim, I. R.; Leonard, J. A.; Posada, D.; Castroviejo, J.; Petrucci-Fonseca, F.; Crandall, K. A.; Ellegren, H. et al. (1999). «Mitochondrial DNA phylogeography and population history of the grey wolf Canis lupus». Molecular Ecology 8 (12): 2089-103. PMID 10632860. doi:10.1046/j.1365-294x.1999.00825.x.
- ↑ a b Leonard, Jennifer A.; Vilà, Carles; Wayne, Robert K. (2004). «Fast Track: Legacy lost: Genetic variability and population size of extirpated US grey wolves (Canis lupus)». Molecular Ecology 14 (1): 9-17. PMID 15643947. doi:10.1111/j.1365-294X.2004.02389.x.
- ↑ a b Larson G, Bradley DG (2014). «How Much Is That in Dog Years? The Advent of Canine Population Genomics». PLOS Genetics 10 (1): e1004093. doi:10.1371/journal.pgen.1004093.
- ↑ Morey, Darcy F.; Jeger, Rujana (2016). «From wolf to dog: Late Pleistocene ecological dynamics, altered trophic strategies, and shifting human perceptions». Historical Biology: 1-9. doi:10.1080/08912963.2016.1262854.
- ↑ Koepfli, K.-P.; Pollinger, J.; Godinho, R.; Robinson, J.; Lea, A.; Hendricks, S.; Schweizer, R. M.; Thalmann, O.; Silva, P.; Fan, Z.; Yurchenko, A. A.; Dobrynin, P.; Makunin, A.; Cahill, J. A.; Shapiro, B.; Álvares, F.; Brito, J. C.; Geffen, E.; Leonard, J. A.; Helgen, K. M.; Johnson, W. E.; O’Brien, S. J.; Van Valkenburgh, B.; Wayne, R. K. (17 de agosto de 2015). «Genome-wide Evidence Reveals that African and Eurasian Golden Jackals Are Distinct Species». Current Biology 25 (16): 2158-65. PMID 26234211. doi:10.1016/j.cub.2015.06.060. Archivado desde el original el 7 de noviembre de 2015. Consultado el 8 de octubre de 2016.
- ↑ a b Van Valkenburgh, Blaire; Hayward, Matthew W.; Ripple, William J.; Meloro, Carlo; Roth, V. Louise (2016). «The impact of large terrestrial carnivores on Pleistocene ecosystems». Proceedings of the National Academy of Sciences 113 (4): 862-867. doi:10.1073/pnas.1502554112.
- ↑ Shipman, P. (2015). The Invaders:How humans and their dogs drove Neanderthals to extinction. Harvard University Press. ISBN 978-0-674-73676-4.
- ↑ Cagan, Alex; Blass, Torsten (2016). «Identification of genomic variants putatively targeted by selection during dog domestication». BMC Evolutionary Biology 16. doi:10.1186/s12862-015-0579-7.
- ↑ Song, Jiao-Jiao; Wang, Wen-Zhi; Otecko, Newton O.; Peng, Min-Sheng; Zhang, Ya-Ping (2016). «Reconciling the conflicts between mitochondrial DNA haplogroup trees of Canis lupus». Forensic Science International: Genetics 23: 83-85. doi:10.1016/j.fsigen.2016.03.008.
- ↑ a b Gross, Michael (2015). «Are dogs just like us?». Current Biology 25 (17): R733-6. PMID 26561653. doi:10.1016/j.cub.2015.08.018.
- ↑ «Ancient wolf genome pushes back dawn of the dog». Nature. 2015.
- ↑ a b Lee, E. (2015). «Ancient DNA analysis of the oldest canid species from the Siberian Arctic and genetic contribution to the domestic dog». PLoS ONE 10 (5): e0125759. PMC 4446326. PMID 26018528. doi:10.1371/journal.pone.0125759.
- ↑ Bocherens, Hervé; Drucker, Dorothée G.; Bonjean, Dominique; Bridault, Anne; Conard, Nicholas J.; Cupillard, Christophe; Germonpré, Mietje; Höneisen, Markus; Münzel, Susanne C.; Napierala, Hannes; Patou-Mathis, Marylène; Stephan, Elisabeth; Uerpmann, Hans-Peter; Ziegler, Reinhard (2011). «Isotopic evidence for dietary ecology of cave lion (Panthera spelaea) in North-Western Europe: Prey choice, competition and implications for extinction». Quaternary International 245 (2): 249-261. doi:10.1016/j.quaint.2011.02.023.
- ↑ Yeakel, J. D.; Guimaraes, P. R.; Bocherens, H.; Koch, P. L. (2013). «The impact of climate change on the structure of Pleistocene food webs across the mammoth steppe». Proceedings of the Royal Society B: Biological Sciences 280 (1762): 20130239. doi:10.1098/rspb.2013.0239.
- ↑ a b Bocherens, Hervé (2015). «Isotopic tracking of large carnivore palaeoecology in the mammoth steppe». Quaternary Science Reviews 117: 42-71. doi:10.1016/j.quascirev.2015.03.018.
- ↑ Vila, C.; Sundqvist, A.-K.; Flagstad, O.; Seddon, J.; Rnerfeldt, S. B.; Kojola, I.; Casulli, A.; Sand, H.; Wabakken, P.; Ellegren, H. (2003). «Rescue of a severely bottlenecked wolf (Canis lupus) population by a single immigrant». Proceedings of the Royal Society B: Biological Sciences 270 (1510): 91-97. doi:10.1098/rspb.2002.2184.
- ↑ a b c Muñoz-Fuentes, Violeta; Darimont, Chris T.; Wayne, Robert K.; Paquet, Paul C.; Leonard, Jennifer A. (2009). «Ecological factors drive differentiation in wolves from British Columbia». Journal of Biogeography 36 (8): 1516-1531. doi:10.1111/j.1365-2699.2008.02067.x.
- ↑ a b c Musiani, Marco; Leonard, Jennifer A.; Cluff, H. Dean; Gates, C. Cormack; Mariani, Stefano; Paquet, Paul C.; Vilà, Carles; Wayne, Robert K. (2007). «Differentiation of tundra/taiga and boreal coniferous forest wolves: Genetics, coat colour and association with migratory caribou». Molecular Ecology 16 (19): 4149-70. PMID 17725575. doi:10.1111/j.1365-294X.2007.03458.x.
- ↑ Valière, Nathaniel; Fumagalli, Luca; Gielly, Ludovic; Miquel, Christian; Lequette, Benoît; Poulle, Marie-Lazarine; Weber, Jean-Marc; Arlettaz, Raphaël et al. (2003). «Long-distance wolf recolonization of France and Switzerland inferred from non-invasive genetic sampling over a period of 10 years». Animal Conservation 6: 83-92. doi:10.1017/S1367943003003111.
- ↑ Fabbri, E.; Caniglia, R.; Kusak, J.; Galov, A.; Gomerčić, T.; Arbanasić, H.; Huber, D.; Randi, E. (2014). «Genetic structure of expanding wolf (Canis lupus) populations in Italy and Croatia, and the early steps of the recolonization of the Eastern Alps». Mammalian Biology - Zeitschrift für Säugetierkunde 79 (2): 138-148. doi:10.1016/j.mambio.2013.10.002.
- ↑ Carmichael, L. E.; Nagy, J. A.; Larter, N. C.; Strobeck, C. (2001). «Prey specialization may influence patterns of gene flow in wolves of the Canadian Northwest». Molecular Ecology 10 (12): 2787-98. PMID 11903892. doi:10.1046/j.0962-1083.2001.01408.x.
- ↑ Carmichael, L. E. (2006). Ecological Genetics of Northern Wolves and Arctic Foxes. Ph.D. Dissertation. University of Alberta.
- ↑ a b Schweizer, Rena M.; Vonholdt, Bridgett M.; Harrigan, Ryan; Knowles, James C.; Musiani, Marco; Coltman, David; Novembre, John; Wayne, Robert K. (2016). «Genetic subdivision and candidate genes under selection in North American grey wolves». Molecular Ecology 25 (1): 380-402. PMID 26333947. doi:10.1111/mec.13364.
- ↑ a b Schweizer, Rena M.; Robinson, Jacqueline; Harrigan, Ryan; Silva, Pedro; Galverni, Marco; Musiani, Marco; Green, Richard E.; Novembre, John et al. (2016). «Targeted capture and resequencing of 1040 genes reveal environmentally driven functional variation in grey wolves». Molecular Ecology 25 (1): 357-79. PMID 26562361. doi:10.1111/mec.13467.
- ↑ O'Keefe, F. Robin; Meachen, Julie; Fet, Elizabeth V.; Brannick, Alexandria (2013). «Ecological determinants of clinal morphological variation in the cranium of the North American gray wolf». Journal of Mammalogy 94 (6): 1223-1236. doi:10.1644/13-MAMM-A-069.
- ↑ Carmichael, L. E.; Krizan, J.; Nagy, J. A.; Fuglei, E.; Dumond, M.; Johnson, D.; Veitch, A.; Berteaux, D. et al. (2007). «Historical and ecological determinants of genetic structure in arctic canids». Molecular Ecology 16 (16): 3466-83. PMID 17688546. doi:10.1111/j.1365-294X.2007.03381.x.
- ↑
- ↑ Rook, L.; Torre, D. (1996). «The wolf-event in western Europe and the beginning of the Late Villafranchian». Neues Jahrbuch fur Geologie und Palaontologie Monatshefte 8: 495-501.
- ↑ Gliozzi, E.; Abbazzi, L.; Argenti, A.; Azzaroli, A.; Caloi, L.; Capasso Barbato, L.; di Stefano, G.; Esu, D.; Ficcarelli, G.; Girotti, O.; Kotsakis, T.; Masini, F.; Mazza, P.; Mezzabotta, C.; Palombo, M. R.; Petronio, C.; Rook, L.; Sala, B.; Sardella, R.; Zanalda, E.; Torre, D. (1997). «Biochronology of selected mammals, Molluscs and ostracodes from the Middle Pliocene to the Late Pleistocene in Italy. The state of the art». Rivista Italiana di Paleontologia e Stratigrafia 103 (3): 369-388. doi:10.13130/2039-4942/5299.
- ↑ Currant, A. P. (1984). The mammalian remains. En Green, H. S., ed. «Pontnewydd Cave: A Lower Palaeolithic Hominid Site in Wales: the First Report». Journal of Archaeological Science 12 (4) (Amgueddfa Genedlaethol Cymru). pp. 177-181. ISBN 978-0-7200-0282-9. doi:10.1016/0305-4403(85)90038-X.
- ↑ Fox-Dobbs, Kena; Leonard, Jennifer A.; Koch, Paul L. (2008). «Pleistocene megafauna from eastern Beringia: Paleoecological and paleoenvironmental interpretations of stable carbon and nitrogen isotope and radiocarbon records». Palaeogeography, Palaeoclimatology, Palaeoecology 261: 30-46. doi:10.1016/j.palaeo.2007.12.011.
- ↑ Baryshnikov, Gennady F.; Mol, Dick; Tikhonov, Alexei N (2009). «Finding of the Late Pleistocene carnivores in Taimyr Peninsula (Russia, Siberia) with paleoecological context». Russian Journal of Theriology (Russian Journal of Theriology) 8 (2): 107-113. Consultado el 23 de diciembre de 2014.
- ↑ Ovodov, N. (2011). «A 33,000-year-old incipient dog from the Altai Mountains of Siberia: Evidence of the earliest domestication disrupted by the Last Glacial Maximum». PLoS ONE 6 (7): e22821. PMC 3145761. PMID 21829526. doi:10.1371/journal.pone.0022821.
- ↑ a b Germonpré, Mietje; Lázničková-Galetová, Martina; Losey, Robert J.; Räikkönen, Jannikke; Sablin, Mikhail V. (2015). «Large canids at the Gravettian Předmostí site, the Czech Republic: The mandible». Quaternary International. 359-360: 261-279. doi:10.1016/j.quaint.2014.07.012.
- ↑ Germonpré, Mietje; Laznickova-Galetova, Martina; Sablin, Mikhail V. (2012). «Palaeolithic dog skulls at the Gravettian Predmosti site, the Czech Republic». Journal of Archaeological Science 39: 184-202. doi:10.1016/j.jas.2011.09.022.
- ↑ Boudadi-Maligne, M. (2010). «Les Canis pleistocenes du sud de la France: approche biosystematique, evolutive et biochronologique. Ph.D. dissertation». Arch´eologie et Pr´ehistoire (Universitie Bordeaux) (4126).
- ↑ Dimitrijević, V.; Vuković, S. (2015). «Was the Dog Locally Domesticated in the Danube Gorges? Morphometric Study of Dog Cranial Remains from Four Mesolithic-Early Neolithic Archaeological Sites by Comparison with Contemporary Wolves». International Journal of Osteoarchaeology 25: 1-30. doi:10.1002/oa.2260.
- ↑ Germonpréa, Mietje; Sablinb, Mikhail V.; Stevensc, Rhiannon E.; Hedgesd, Robert E. M.; Hofreitere, Michael; Stillere, Mathias; Desprése, Viviane R. (2008). «Fossil dogs and wolves from Palaeolithic sites in Belgium, the Ukraine and Russia: osteometry, ancient DNA and stable isotopes». Journal of Archaeological Science 36 (2): 473-490. doi:10.1016/j.jas.2008.09.033.
- ↑ Larson G (2012). «Rethinking dog domestication by integrating genetics, archeology, and biogeography». PNAS 109 (23): 8878-8883. PMC 3384140. PMID 22615366. doi:10.1073/pnas.1203005109.






