| Hexafluoroaluminato de sodio | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Otros nombres |
Fluoroaluminato de sodio | |
| Fórmula estructural |
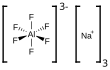 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 13775-53-6[1] | |
| Número RTECS | WA9625000 | |
| ChEBI | 39289 | |
| ChemSpider | 11431435 | |
| PubChem | 16693908 | |
| UNII | 5ZIS914RQ9 | |
| KEGG | C18816 | |
| Propiedades físicas | ||
| Masa molar | 209,941266 g/mol | |
| Índice de refracción (nD) | 1,3389 | |
El hexafluoroaluminato de sodio o hexafluoruro de sodio y aluminio es un compuesto inorgánico de fórmula Na3AlF6. Es un sólido blanco, descubierto por José Bonifácio de Andrada e Silva, que se produce naturalmente como el mineral criolita. Se utiliza ampliamente en la producción industrial de aluminio metálico. El compuesto es la sal de sodio (Na+) del ion hexafluoroaluminato (AlF63-).
Producción
La mayoría de la criolita se fabrica a partir de óxidos de aluminio, ácido fluorhídrico e hidróxido de sodio o el reactivo equivalente ácido hexafluorosilícico:[2]
- 6 NaOH + Al2O3 + 12 HF → 2 Na3AlF6 + 9 H2O
La criolita mineral se extrajo en Ivigtût, en la costa occidental de Groenlandia, hasta que el depósito se agotó, en 1987.
Usos
La principal aplicación de la criolita sintética es como disolvente (o como fundente) para la electrólisis de óxidos de aluminio como la bauxita. La conversión de óxidos de aluminio en aluminio metálico requiere que los iones metálicos se disuelvan para que puedan aceptar los electrones proporcionados en la celda de electrólisis. Como disolvente se utiliza una mezcla de criolita y algo de fluoruro de aluminio. A diferencia de las soluciones típicas, para fundirse, esta requiere temperaturas cercanas a 1000 °C. El hexafluoruro de sodio y aluminio también se utiliza como pesticida. Otros usos incluyen un blanqueador para esmaltes y un opacificante para vidrio.[3]
Solubilidad
La criolita es poco soluble en agua. La dosis letal media (LD50) es de 600 mg/kg para el compuesto comparable fluoruro de aluminio.[2]
Referencias
- ↑ Número CAS
- ↑ a b J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, J. P. Cuer, "Fluorine Compounds, Inorganic" in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi 10.1002/14356007.a11_307
- ↑ «Copia archivada». Archivado desde el original el 5 de noviembre de 2016. Consultado el 2 de septiembre de 2020.
Enlaces externos
- Esta obra contiene una traducción derivada de «Sodium hexafluoroaluminate» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
